-
下列实验结论不正确的是( )
选项
操作
现象
结论
A
新制的银氨溶液与葡萄糖溶液混合加热
有银镜生成
葡萄糖具有还原性
B
向澄清石灰水溶液中通入适量气体Y
出现白色沉淀
Y可能是CO2气体
C
向鸡蛋清溶液中滴入浓硝酸
产生黄色沉淀
鉴别部分蛋白质
D
向盛Na2SiO3溶液的试管中逐滴加入稀盐酸
2min后,试管里出现白色胶状沉淀
非金属性Cl>Si
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
1869年俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要里程碑之一。下列有关元素周期表的说法正确的是( )
A. 元素周期表有7个横行、18个纵行,即有7个周期、18个族
B. 在过渡元素中寻找半导体材料
C. 俄罗斯专家首次合成了178116X原子,116号元素位于元素周期表中第7周期VIA族
D. IA族的元素全部是金属元素
难度: 简单查看答案及解析
-
如下表所示,为提纯下列物质(括号内为少量杂质),所选用的除杂试剂与主要分离方法都正确的是 ( )
选项
不纯物质
除杂试剂
分离方法
A
乙烷(乙烯)
KMnO4(酸化)
洗气
B
溴苯(溴)
NaOH溶液
分液
C
苯(乙烯)
溴水
分液
D
CO2(SO2)
碳酸钠溶液
洗气
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
如图为元素周期表短周期的一部分,Z原子的电子层数为n,最外层电子数为2n+1。下列叙述不正确的是( )
R
M
X
Y
Z
A. R、Y、Z的最高价氧化物对应的水化物的酸性依次增强
B. X和Z的简单氢化物的热稳定性和还原性均依次减弱
C. R、M和氢三种元素形成的阴离子有2种以上
D. RY2分子中每个原子的最外层均为8电子稳定结构
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价的绝对值相等,Z的核电荷数是Y的2倍,W的最外层电子数是其最内层电子数的3倍。下列说法不正确的是( )
A. 原子半径:Z>W>R
B. R、W对应的简单阴离子具有相同的电子层结构
C. W与X、W与Z形成的化合物的化学键类型完全相同
D. Y的最高价氧化物对应的水化物是弱酸
难度: 中等查看答案及解析
-
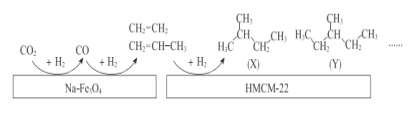
1mol某气态烃最多可与2molHCl发生加成反应,所得产物与Cl2发生取代反应时,若将氢原子全部取代,需要8molCl2,由此可知该烃结构简式可能为( )
A. CH≡CH B. CH3—C≡CH
C. CH2=CH—CH=CH—CH3 D. CH3—C≡C—CH3
难度: 中等查看答案及解析
-
化学与生产、生活密切相关。下列说法正确的是( )
A. 生物柴油的成分为液态烃的混合物
B. 大量生产和使用活性炭防PM2.5口罩应对雾霾属于“绿色化学”范畴
C. 聚乙烯、油脂和淀粉均属于有机高分子化合物
D. HgCl2可用作防腐剂和杀菌剂,是因为它能使蛋白质发生变性
难度: 简单查看答案及解析
-
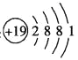
最近科学家发现使用钾和铜的微小尖峰可将二氧化碳和水转变为乙醇。下列有关化学用语表示正确的是 ( )
A. 二氧化碳的比例模型:
 B. 中子数为34,质子数为29的铜原子:6334
B. 中子数为34,质子数为29的铜原子:6334C. 钾原子的结构示意图:
 D. 乙醇的结构简式:CH3OCH3
D. 乙醇的结构简式:CH3OCH3难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 1L0.1mol/L的氨水中含有0.1NA个OH-
B. 常温下,在18g D2O中含有NA个氧原子
C. 常温下,7.8 g苯中所含C—H数为0.6NA
D. 标准状况下,11.2L乙烯含有非极性共价键数目为3NA
难度: 简单查看答案及解析
-
下列每组物质中含有的化学键类型相同化合物的是( )
A. NaCl、HCl、NaOH B. Na2S、H2O2、H2O
C. Cl2、H2SO4、SO2 D. HBr、 CO2、SiO2
难度: 简单查看答案及解析
-
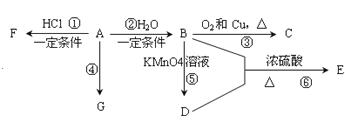
下列物质间的关系,描述不正确的是( )
A.
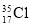 与
与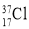 互为同位素
互为同位素B.甲酸和乙酸互为同系物
C.
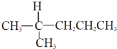 和
和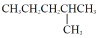 属于同分异构体
属于同分异构体D.金刚石、足球烯互为同素异形体
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 浓硫酸具有强氧化性,不能干燥二氧化硫气体
B. 向50mL18mol•L -1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
C. 浓硫酸与浓盐酸长期暴露在空气中浓度降低的原理相同
D. 将铁屑溶于过量盐酸后,再加入硝酸锌,会有三价铁生成
难度: 中等查看答案及解析
-
下列关于有机物说法正确的是( )
A. 植物油、裂化汽油均能使酸性高锰酸钾褪色 B. 糖类、油脂、蛋白质在一定条件下均能水解
C. CH3CH==CH2所有原子共平面 D. 化学式C2H4O2表示的物质一定是纯净物
难度: 简单查看答案及解析
-
下列反应中前者属于取代反应,后者属于加成反应的是( )
A.油脂与浓NaOH反应制高级脂肪酸钠;乙烯使酸性高锰酸钾溶液褪色
B.乙炔使溴的四氯化碳溶液褪色;乙烯与水反应生成乙醇
C.在苯中滴入溴水,溴水褪色;氯乙烯制备聚氯乙烯
D.苯滴入浓硝酸和浓硫酸的混合液中水浴加热;苯与氢气在一定条件下反应生成环己烷
难度: 简单查看答案及解析
-
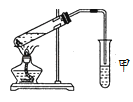
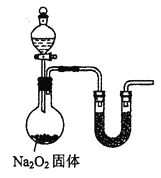
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( )
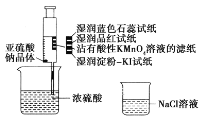
A. 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2
B. 蓝色石蕊试纸先变红后褪色
C. NaCl溶液可用于除去实验中多余的SO2
D. 品红试纸、沾有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. NaHSO4溶于水只需要克服离子键
B. 单质分子中都存在化学键
C. 晶体熔沸点由高到低的顺序为:金刚石>碳化硅>氯化钠
D. 干冰气化,克服了共价键和分子间作用力
难度: 简单查看答案及解析
-
在光照的条件下,将1 mol甲烷与一定量的氯气充分混合,经过一段时间,甲烷和氯气均无剩余,生成一氯甲烷、二氯甲烷、三氯甲烷、四氯化碳和氯化氢,若已知生成的二氯甲烷、三氯甲烷、四氯化碳的物质的量分别为a mol,b mol,c mol,该反应中消耗的氯气的物质的量是( )
A. (1+a+b+c)mol B. (2a+3b+4c)mol
C. (1+a+2b+3c) mol D. (a+b+c)mol
难度: 简单查看答案及解析
-
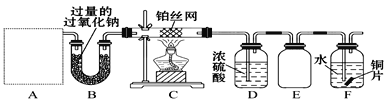
SO2 通入 BaCl2 溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀。则图中右侧 Y 形管中放置的药品组合符合要求的是( )
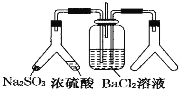
①Cu 和浓硝酸 ②氢氧化钠固体和浓氨水 ③大理石和稀盐酸 ④过氧化氢和二氧化锰
A. ①②④ B. 全部 C. ②③ D. ①③
难度: 中等查看答案及解析
-
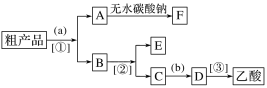
下列实验能达到预期目的是( )
A. 制溴苯
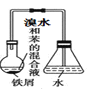
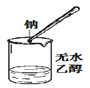
B. 检验无水乙醇中是否有水
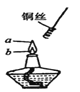
C. 从a处移到b处,观察到铜丝由黑变红
D. 制取少量乙酸乙酯
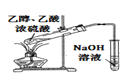
难度: 中等查看答案及解析
-
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是( )
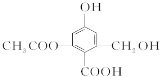
A. X的化学式为C10H10O6
B. X分子中含有官能团为羟基、羧基和酯基
C. X在一定条件下只能和酸发生酯化反应,不能和醇发生酯化反应
D. 1 mol X分别与足量的Na、NaHCO3溶液反应,消耗这两种物质的物质的量分别为3 mol、1 mol
难度: 中等查看答案及解析
-
常温常压下,a、b、c三支相同的试管中,分别装入以等物质的量混合的两种气体,a试管内是NO2与O2,b试管内为Cl2和SO2,c试管内是NH3与N2,将三支试管同时倒立于水中,最终各试管中水面上升高度顺序应为( )
A. a=b>c B. b>a>c C. c>b>a D. b>c>a
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48L(气体体积均在标准状况下测定,下同),这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,消耗NaOH溶液的体积是60mL。下列说法不正确的是
A.此反应过程中转移的电子为0.6mol
B.消耗氧气的体积是1.68L
C.混合气体中含NO23.36L
D.参加反应的硝酸是0.5mol
难度: 中等查看答案及解析