-
下列说法正确的是( )
A. 纤维素、花生油、蚕丝在一定条件下都能发生水解反应
B. 煤的干馏是化学变化,煤的气化、液化和石油的分馏都是物理变化
C. 新戊烷用系统命名法命名为2,2-二甲基戊烷
D. 正四面体烷(
 )与立方烷(
)与立方烷(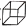 )的二氯代物数目相同
)的二氯代物数目相同难度: 中等查看答案及解析
-
NA 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,1.12L 三氯甲烷(CHCl3)含有的化学键数目为0.2 NA
B.0.1mol-NH2 (氨基)中所含有的电子数NA
C.1L0.1mol·L-1Na2S溶液中,S2-、HS-和H2S的微粒数之和为0.2NA
D.乙烯和环丁烷(C4H8)的混合气体共28 g充分燃烧消耗3NA个O2
难度: 中等查看答案及解析
-
通过对实验现象的观察、分析推理得出正确的结论是化学学习的方法之一。对下列实验操作、现象、结论或解释正确的是
选项
实验操作
现象
结论或解释
A
向Na2S溶液中滴加盐酸
有臭鸡蛋气味的气体产生
氯的非金属性比硫的强
B
向Ba(NO3)2溶液中通入SO2气体
产生白色沉淀
沉淀是BaSO3
C
将0.1mol/L ZnSO4溶液加入1mol/LNa2S溶液至不再有沉淀产生,再滴加0.1mol/L CuSO4溶液
先有白色沉淀生成后变为黑色沉淀
Ksp(CuS) > Ksp(ZnS)
D
向某溶液中滴加K 3[Fe(CN)6] (铁氰化钾) 溶液
有蓝色沉淀产生
该溶液中一定含有Fe2+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
甲醇燃料电池是目前应用比较广泛的一种燃料电池,其工作原理如下图所示:
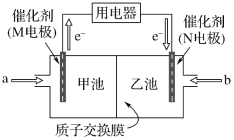
下列说法正确的是( )
A.N为正极,发生氧化反应
B.a为氧气,b为甲醇
C.甲池溶液pH增大,乙池溶液pH减小
D.若有1 mol CO2生成,则有6 mol H+从甲池透过交换膜进入乙池
难度: 中等查看答案及解析
-
Y是一种皮肤病用药,它可以由原料X经过多步反应合成。
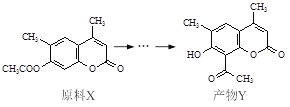
下列说法正确的是
A.X与Y互为同分异构体
B.1mol X最多可以与5mol H2发生加成反应
C.产物Y能发生氧化、加成、取代、消去反应
D.1 molY最多能与2mol NaOH发生反应
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.甲苯既可使溴的CCl4溶液褪色,也可使KMnO4酸性溶液褪色
B.有机物
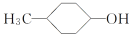 的消去产物有2种
的消去产物有2种C.鉴别乙醇和苯:将少量的酸性KMnO4溶液分别滴入少量的乙醇和苯中
D.有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CHCOOCH3
难度: 中等查看答案及解析
-
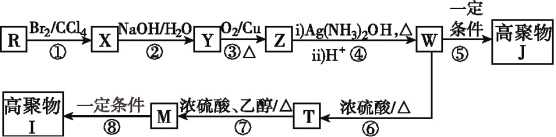
由丁醇(X)制备戊酸(Z)的合成路线如图所示,不正确的是
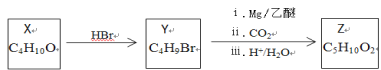
A.Y的结构有4种
B.X、Z能形成戊酸丁酯,戊酸丁酯最多有16种
C.与X互为同分异构体,且不能与金属钠反应的有机物有4种
D.与Z互为同分异构体,且能发生水解反应的有机物有9种
难度: 困难查看答案及解析
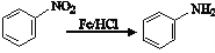
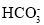 )∶c(
)∶c(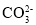 )=___________[已知H2CO3的电离平衡常数为:K1=4.4×10−7、K2=5×10−11],溶液中c(Na+)_______ c(
)=___________[已知H2CO3的电离平衡常数为:K1=4.4×10−7、K2=5×10−11],溶液中c(Na+)_______ c(
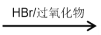 R′CH2CH2Br
R′CH2CH2Br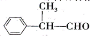 的合成路线(无机试剂任选):____________。
的合成路线(无机试剂任选):____________。