-
下列说法正确的是( )
A.海洋中氯元素含量很大,因此氯元素被称为“海洋元素”
B.SO2有漂白性因而可使品红溶液、溴水褪色.
C.实验室从海带中提取单质碘的过程:取样→灼烧→溶解→过滤→萃取
D.将植物的秸秆加入沼气发酵池中生成沼气属于生物质能的生物化学转换
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.H2O分子间存在氢键,所以H2O比H2S稳定
B.He、CO2和CH4都是由分子构成,它们中都存在共价键
C.PCl5中各微粒最外层均达到8电子稳定结构
D.NaHCO3受热分解生成Na2CO3、CO2和H2O,既破坏了离子键,也破坏了共价键
难度: 中等查看答案及解析
-
“野火烧不尽,春风吹又生”是唐代诗人白居易的若名诗句。下列关于该诗句中所涉及的说法不正确的是
A.“野火烧”属于生物质能的热化学转换
B.自然界中“春风吹又生”涉及到太阳能与化学能之间的转化
C.诗句“春风吹又生”说明生物质能属于可再生的新能源
D.野草成份中的纤维素属于有机物,而火烧后草木灰中的主要成份K2CO3属于盐
难度: 简单查看答案及解析
-
下列有关物质性质与用途描述正确且具有对应关系的是
A.浓硫酸具有脱水性,可用作某些气体的干燥剂
B.Na2O2吸收CO2产生O2,可用作呼吸面具供氧剂
C.SO2具有还原性,可用作草帽、纸浆的漂白剂
D.12C的放射性,可用作考古断代
难度: 简单查看答案及解析
-
化学反应速率的大小主要决定于
A.反应物的浓度 B.反应的温度和压强 C.催化剂 D.反应物的性质
难度: 简单查看答案及解析
-
下列实验结论与实验操作及现象不相符的一组是( )
选项
实验操作及现象
实验结论
A
向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成
酸雨试样中一定含SO42-
B
向KI-淀粉溶液中滴入氯水,溶液变成蓝色
I-的还原性强于Cl-
C
将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉
Ba(OH)2·8H2O与NH4Cl的反应是吸热反应
D
向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝
该盐溶液中含有NH4+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
从草木灰中获取可溶性盐的实验过程中,下列操作未涉及的是( )
A.
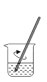 B.
B. 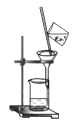 C.
C. 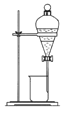 D.
D. 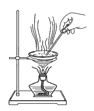
难度: 简单查看答案及解析
-
2019年是元素周期表诞生的第150周年,联合国大会宣布2019年是“国际化学元素周期表年”。下列关于周期表、周期律叙述正确的是
A.离子半径:F->O2-
B.金属性:Al<81Tl
C.非金属性:Cl>S,故酸性:HCl>H2S
D.在同周期,第IIA族和第IIIA族元素原子序数相差可能为1、11、24
难度: 简单查看答案及解析
-
密闭容器中发生可逆反应:H2(g)+I2(g)
 2HI(g)达到平衡状态时的标志是
2HI(g)达到平衡状态时的标志是A.容器的压强恒定不变
B.混合气体的颜色不再改变
C.H2、I2、HI的浓度相等
D.I2在混合气体中的体积分数与H2在混合气体中的体积分数相等
难度: 中等查看答案及解析
-
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍。下列说法不正确的是( )
A.原子半径Z>W>R B.W与X、W与Z形成的化学键类型完全相同
C.对应的氢化物的热稳定性:R>W D.Y的最高价氧化物对应的水化物是弱酸
难度: 中等查看答案及解析
-
下列离子反应方程式书写正确的是
A.往稀盐酸中逐滴加入Na2CO3溶液,开始时:H++CO
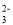 =HCO
=HCO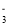
B.草酸(H2C2O4,弱酸)溶液中加入酸性KMnO4溶液: 2MnO
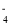 +5C2O
+5C2O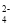 +16H+=2Mn2++10CO2↑+8H2O
+16H+=2Mn2++10CO2↑+8H2OC.往少量澄清石灰水中加入Ca(HCO3)2溶液: Ca2++OH-+HCO
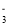 =CaCO3↓+H2O
=CaCO3↓+H2OD.用HI溶液溶解Fe2O3固体:Fe2O3+6H+=2Fe3++3H2O
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.反应5NH4NO3=2HNO3+4N2↑+9H2O,生成22.4LN2时转移的电子数为3.75NA
B.1 mol浓硫酸与足量Mg完全反应,转移电子数可能为NA
C.标准状况下甲烷(CH4)和氧气(氧气充足)的混合气体共22.4L,完全燃烧后产物的分子总数一定为NA
D.10g的D2O中含有的质子数与中子数分别为5NA和4NA
难度: 中等查看答案及解析
-
合成气转变为甲醇过程中,涉及如下反应:CO(g)+2H2(g)
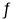 CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是
CH3OH(g) △H=-90.8kJ/mol,现向体积为2L的恒容绝热(起始温度为T)密闭容器中充入1 mol CO和2 mol H2,反应经5min后达到平衡,测得CO的转化率为50%。下列说法不正确的是A.在0~5min内,v(H2)=0.1 mol·L-1·min-1
B.当反应达到平衡时,CO和H2的物质的量之比为1:2
C.其他条件不变时,若将该体系换成恒温(起始温度为T)恒容密闭容器,则CO的平衡转化率将增大
D.5min后,将甲醇液化分离出,此时平衡正向移动,正反应速率增大
难度: 中等查看答案及解析
-
2 mol金属钠和l mol氯气反应的能量关系如图所示,下列说法不正确的是:( )
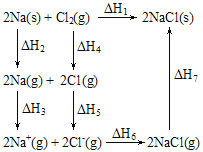
A.原子失电子为吸热过程,相同条件下,K(s)的(△H2'+△H3')<Na(s)的(△H2+△H3)
B.△H4的值数值上和Cl-Cl共价键的键能相等
C.△H2+△H3+△H4+△H5>-(△H6+△H7)
D.2Na(s)+Cl2(g)=2NaCl(s)在较低温度下自发进行
难度: 中等查看答案及解析
-
已知还原性:
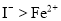 ,某溶液中含如下离子组中的几种
,某溶液中含如下离子组中的几种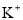 、
、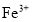 、
、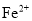 、
、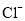 、
、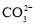 、
、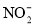 、
、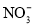 、
、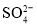 、
、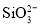 、
、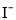 ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:①用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰;
②另取原溶液加入足量盐酸有无色气体生成,该气体遇空气变成红棕色,此时溶液颜色加深,但无沉淀生成;
③取②反应后溶液置于试管中加入
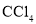 ,充分振荡静置后溶液分层,下层为无色。
,充分振荡静置后溶液分层,下层为无色。下列说法正确的是( )
A.②中无色气体是
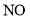 气体,可能含有
气体,可能含有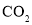 气体
气体B.原溶液中
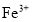 与
与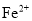 只存在一种离子
只存在一种离子C.原溶液中
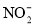 与
与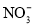 至少存在一种离子
至少存在一种离子D.为确定是否含有
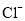 可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀难度: 困难查看答案及解析
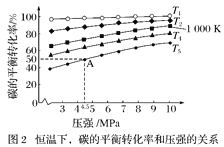
 zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是
zC(g),图Ⅰ表示200 ℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随走始n(A)∶n(B)的变化关系。则下列结论正确的是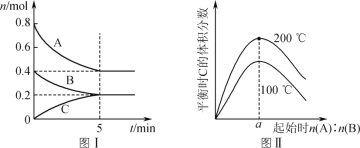
 2NO2(g),下列各项能说明反应达到平衡状态的是_____________。
2NO2(g),下列各项能说明反应达到平衡状态的是_____________。 CH3OH(g),达平衡后测得各组分浓度:
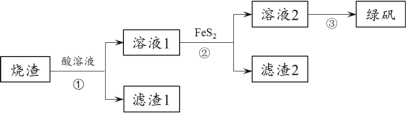
CH3OH(g),达平衡后测得各组分浓度: CH4(g) ΔH。
CH4(g) ΔH。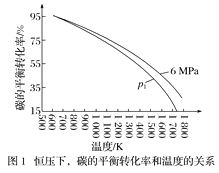
 O2(g)
O2(g)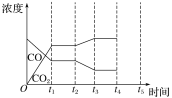
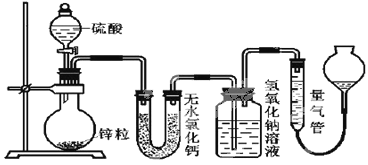
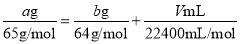 ,依据的原理是___。
,依据的原理是___。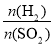 =__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,
=__(用含字母的代数式表示)。若撤走盛有无水氯化钙的U型管,