-
糖类又称碳水化合物,是人体所需的重要营养物质,葡萄糖中不含有的元素是
A.氢 B.碳 C.氮 D.氧
难度: 简单查看答案及解析
-
扬州拥有众多非物质文化遗产项目,下列过程涉及化学变化的是
A.玉石雕刻

B.纸张裁剪

C.木料打磨

D.腐乳发酵

难度: 简单查看答案及解析
-
NaOH可用于造纸和印染工业,NaOH属于
A.单质 B.酸 C.碱 D.盐
难度: 简单查看答案及解析
-
下列物质由离子构成的是
A.氢气 B.氯化钾 C.金刚石 D.二氧化碳
难度: 简单查看答案及解析
-
不同的物质溶于水后会形成酸碱性不同的溶液,下列溶液显酸性的是
A.食醋 B.氨水 C.NaCl溶液 D.Na2CO3溶液
难度: 简单查看答案及解析
-
氧气是空气的主要成分之一。下列说法不正确的是
A.通常状况下,O2是无色气体
B.相同条件下,O2的密度大于CO2的
C.分离液态空气可获得O2
D.O2能够支持可燃物的燃烧
难度: 简单查看答案及解析
-
对反应进行分类有助于认识与研究,下列反应属于化合反应的是
A.
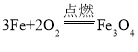
B.
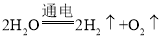
C.
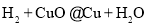
D.
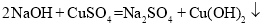
难度: 简单查看答案及解析
-
潜艇供氧的一种反应原理为
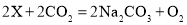 ,其中X的化学式是( )
,其中X的化学式是( )A.Na B.Na2O C.Na2O2 D.NaOH
难度: 简单查看答案及解析
-
培养垃圾分类的好习惯,为改善生活环境作努力,空的塑料矿泉水瓶应投入的垃圾箱上所印标识是
A.

B.

C.

D.

难度: 简单查看答案及解析
-
扬州被誉为“中国运河第一城”,保护水资源是每个公民的责任。下列说法正确的是
A.河水属于纯净物
B.明矾可用于自来水的杀菌消毒
C.生活污水可直接排放入运河
D.自然界水循环的主要途径是水的三态转化
难度: 简单查看答案及解析
-
硫酸是一种重要的工业原料,下列说法不正确的是
A.浓硫酸可用于干燥O2
B.浓硫酸可使纸张炭化
C.实验室可用块状石灰石与稀硫酸制备CO2
D.稀硫酸可用于金属表面除锈
难度: 简单查看答案及解析
-
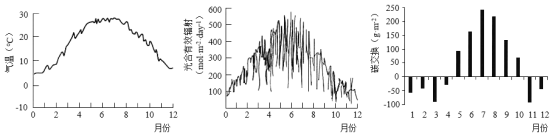
粗盐提纯实验包含称量,溶解、过滤和蒸发,下列装置和操作能达到实验目的的是
A.量取10mL水
 B.溶解粗盐
B.溶解粗盐
C.过滤悬浊液
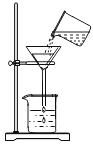 D.蒸发滤液
D.蒸发滤液
难度: 简单查看答案及解析
-
甘油(C3H8O3)具有保湿作用。下列关于甘油的说法不正确的是
A.由3种元素组成
B.相对分子质量为(
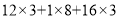 )
)C.碳、氢、氧3种原子的个数比为3:8:3
D.碳元素的质量分数为

难度: 简单查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
将铁钉放CuSO4溶液中,铁钉表面析出红色物质
Fe的金属活动性比Cu强
B
将燃着的木条伸入集气瓶中,木条熄灭
瓶中气体为CO2
C
将某布料置于酒精灯火焰上灼烧,闻到烧焦羽毛的气味
该布料中不含蛋白质
D
向某水样中加入适量皂水,振荡,产生白色的垢状物
该水样为软水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某反应前后分子变化的微观示意图如下,下列说法正确的是( )

A.反应后原子的数目增加
B.反应后原子的种类增加
C.反应前后分子的数目不变
D.反应前后物质的总质量不变
难度: 简单查看答案及解析
-
KNO3与NaCl的溶解度曲线如图所示。下列说法正确的是
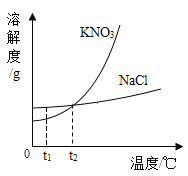
A.NaCl的溶解度受温度影响的程度比KNO3的大
B.T1时,KNO3的溶解度比NaCl的大
C.T2时,KNO3与NaCl的饱和溶液质量分数相等
D.将T1时KNO3的不饱和溶液升温至T2,溶液变为饱和(不考虑溶剂蒸发)
难度: 简单查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.铝具有良好的导电性,可用于制作电线
B.酒精具有挥发性,可用于杀菌消毒
C.碳酸氢铵受热易分解,可用作氮肥
D.金刚石对光线的折射率较大,可用于切割玻璃
难度: 简单查看答案及解析
-
一定质量的CH4可与常见物质M反应,同时放出少量热量;将所得产物Cu2O与O2反应又生成M,同时放出较多热量。其反应原理如下图所示。下列说法正确的是
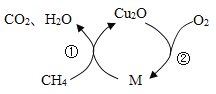
A.M中铜元素的质量分数比Cu2O中的高
B.理论上反应每生成44gCO2,同时生成18gH2O
C.理论上每16gCH4参与反应,最终消耗64gO2
D.过程①可将CH4中的部分能量储存于Cu2O中
难度: 中等查看答案及解析


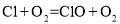 Ⅰ
Ⅰ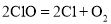 Ⅱ
Ⅱ
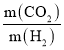 =___________。
=___________。
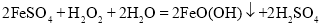
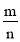 =_____________。
=_____________。