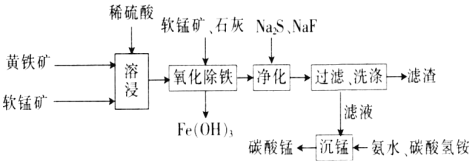
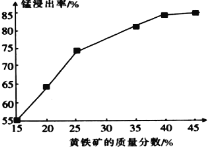
-
化学与人类的生活、生产密切相关,下列有关说法不正确的是( )
A.将海水中的镁转化为氯化镁,再电解熔融氯化镁可制得金属镁
B.稻草秸秆和甘蔗渣中富含纤维素,可以用它来制造纸张
C.新型冠状病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同
D.煤、石油可用作三大合成材料的原料
难度: 简单查看答案及解析
-
用化学用语表示NH3+HCl=NH4Cl中的相关微粒,其中正确的是( )
A.NH4Cl的电离方程式NH4Cl
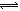 NH3↑+HCl
NH3↑+HClB.HCl的电子式:
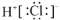
C.NH3的结构式:
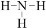
D.Cl-的结构示意图:
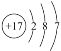
难度: 简单查看答案及解析
-
我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法正确的是( )
A.元素的金属性:K>Rb
B.中子数为50的Rb的核素:
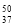 Rb
RbC.与同周期元素53I的原子半径比:Rb<I
D.最高价氧化物对应的水化物的碱性:KOH<RbOH
难度: 中等查看答案及解析
-
下列关于酸、碱、盐元素组成的说法中,正确的是( )
A.酸、碱一定含有氢,盐一定不含氢
B.酸、碱、盐可能都不含金属元素
C.碱、盐可能含氧,酸一定含氧
D.盐、碱一定含有金属元素,酸一定不含金属元素
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.乙醇可以被酸性重铬酸钾溶液氧化,该反应原理用于检验司机是否酒后驾车
B.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
C.不能用溴水来区分乙酸、乙醇、苯乙烯
D.纤维素属于糖类,人体中没有水解纤维素的酶
难度: 简单查看答案及解析
-
下列关于有机化合物的说法正确的是( )
A.乙苯的一氯代物只有5种
B.2-甲基丁烷也称为异丁烷
C.糖类、油脂、蛋白质均能发生水解反应
D.甲苯、植物油都可作溴水的萃取剂
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,22.4 L Cl2溶于水充分反应转移NA个电子
B. 标准状况下,2.24 L HF与1.6 g CH4分子所含电子数目均为NA
C. 50 g质量分数为46%的乙醇溶液中氢原子总数为6NA
D. 25 ℃时,1 L 2 mol/L NH4Cl溶液和1 L 1 mol/L (NH4)2SO4溶液中所含NH4+的数目均为2NA
难度: 中等查看答案及解析
-
利用如图装置可以进行实验并能达到实验目的的是
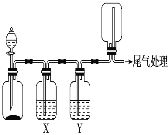
选项
实验目的
X中试剂
Y中试剂
A
用MnO2和浓盐酸制取并收集纯净干燥的Cl2
饱和食盐水
浓硫酸
B
用Cu与稀硝酸制取并收集纯净干燥的NO
水
浓硫酸
C
CaCO3和稀盐酸制取并收集纯净干燥的CO2
饱和NaHCO3溶液
浓硫酸
D
用CaO与浓氨水制取并收集纯净干燥的NH3
NaOH溶液
碱石灰
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列装置完成相关实验,合理的是( )

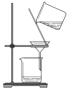

A.配制溶液,定容时的操作
B.除去水中泥沙
C.除去CO中的CO2气体
D.实验室制取乙酸乙酯
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
在生成、纯化溴苯并证明取代反应的实验过程中,下列操作未涉及的是( )
A.
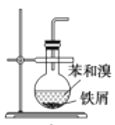 B.
B.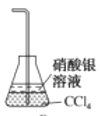 C.
C.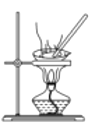 D.
D.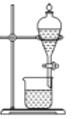
难度: 中等查看答案及解析
-
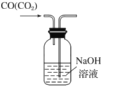
实验室为探究铜与浓硫酸(足量)的反应,并验证SO2的性质,设计如图所示装置进行实验,下列说法错误的是( )
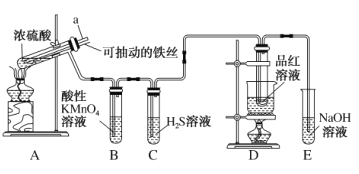
A.装置B、C的目的分别是验证二氧化硫的还原性、氧化性
B.实验结束后可向装置A的溶液中加水,以验证是否有蓝色溶液生成
C.装置D的目的是验证SO2的漂白性及漂白的不稳定性
D.实验时将导管a插入浓硫酸中,可防止装置B中的溶液倒吸
难度: 简单查看答案及解析
-
某学习小组欲根据侯德榜制碱的原理制备少量纯碱。下列实验步骤对应的实验装置(夹持装置已略去)和相关解释或说明均正确的是( )
选项
A
B
C
D
实验步骤
制备NH3
制备NaHCO3
分离NaHCO3
煅烧NaHCO3
实验装置

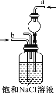

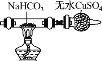
解释或说明
试剂X可选择NH4Cl
从a口通入足量NH3,再从b口通入足量CO2,可增大产品的产率
该装置可用于分
离NaHCO3
无水CuSO4的作用是检验NaHCO3是否完全分解
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列实验操作、现象和结论都正确的是
选项
实验操作和现象
结论或解释
A
向NH4Al(SO4)2溶液中逐滴滴加NaOH溶液至过量,立即出现沉淀后沉淀不变,最后沉淀全部溶解
Al3+先与OH反应,NH4+后与OH
反应,Al(OH)3最后与OH-反应
B
将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,溶液变为红色
样品已部分或全部变质
C
加热盛有少量NH4HCO3固体的试管,并在试管口放置润湿的红色石蕊试纸,石蕊试纸变蓝
NH4HCO3显碱性
D
向某黄色溶液中加入淀粉KI溶液,溶液呈蓝色
溶液中含Br2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
根据下列操作和现象所得到的结论正确的是()
操作和现象
结论
A
向碳酸钙中加入盐酸,产生的气体经饱和碳酸氢钠溶液洗气后,再通入硅酸钠溶液,出现白色沉淀
利用该实验可以证明非金属性:Cl>C>Si
B
将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明
生成的1,2-二溴乙烷无色,能溶于四氯化碳
C
向淀粉溶液中加入稀硫酸加热,再向其中加入过量的氢氧化钠溶液最后加碘水,溶液未变蓝
淀粉已经完全水解
D
将浸透石蜡油的石棉放在硬质试管的底部,试管中加入碎瓷片,用酒精灯给碎瓷片加强热,将产生的气体通入酸性高锰酸钾溶液中,溶液颜色逐渐褪去
蜡油分解产物一定为乙烯
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组物质中,能一步实现下图所示①~⑤转化关系的是
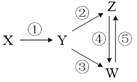
X
Y
Z
W
A
C
CO
CO2
Na2CO3
B
Fe3O4
Fe
FeCl2
FeCl3
C
H2SO4
SO2
S
SO3
D
Al
Al2O3
NaAlO2
Al(OH)3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列离子方程式能用来解释相应实验现象的是
A.氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解:Mg(OH)2+2
 =Mg2++2NH3•H2O
=Mg2++2NH3•H2OB.沸水中滴加饱和氯化铁溶液得到红褐色液体:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:
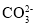 +2CH3COOH=2CH3COO+H2O+CO2↑
+2CH3COOH=2CH3COO+H2O+CO2↑D.84消毒液与洁厕灵混用产生有毒气体:ClO-+Cl-+2H+=Cl2↑+2OH-
难度: 中等查看答案及解析
-
W、X、Y、Z为原子序数依次增大的短周期主族元素,W、X处于不同周期,原子的最外层电子数X比Y多一个但比Z少一个。下列说法正确的是( )
A.原子半径的大小:Z>Y>X>W
B.若X的单质为常见的非金属导体,则Y的简单离子能破坏水的电离平衡
C.元素的非金属性:Y>Z
D.若Y、Z的核电荷数之和为X的4倍,则X、Z的气态氢化物的沸点:前者低于后者
难度: 简单查看答案及解析
-
如图所示,电化学原理与微生物工艺相组合的电解脱硝法,可除去引起水华的NO3-原理是将NO3-还原为N2。下列说法正确的是( )

A. 若加入的是
 溶液,则导出的溶液呈碱性
溶液,则导出的溶液呈碱性B. 镍电极上的电极反应式为:

C. 电子由石墨电极流出,经溶液流向镍电极
D. 若阳极生成
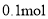 气体,理论上可除去
气体,理论上可除去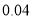 mol
mol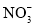
难度: 中等查看答案及解析
-
水热法制备Fe3O4纳米颗粒的总反应的离子方程式为3Fe2++2
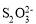 +O2+4OH-===Fe3O4+
+O2+4OH-===Fe3O4+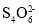 +2H2O。下列说法正确的是()
+2H2O。下列说法正确的是()A.O2和
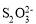 是氧化剂,Fe2+是还原剂
是氧化剂,Fe2+是还原剂B.参加反应的氧化剂与还原剂的物质的量之比为1∶5
C.每生成1mol
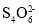 转移2mol电子
转移2mol电子D.每2molFe2+被氧化,则被Fe2+还原的O2为0.5mol
难度: 中等查看答案及解析
-
25℃时,已知醋酸的电离常数为1.8×10-5。向20mL 2.0mol/LCH3COOH溶液中逐滴加入2.0mol/LNaOH溶液,溶液中水电离出的c(H+)在此滴定过程中变化曲线如下图所示。下列说法不正确的是

A.a点溶液中:c(H+)=6.0
 10-3mol
10-3mol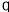 L-1
L-1B.b点溶液中:c(CH3COOH)>c(Na+)>c(CH3COO-)
C.c点溶液中:c(OH-)=c(CH3COOH)+ c(H+)
D.d点溶液中:c(Na+)=2c(CH3COO-)+2c(CH3COOH)
难度: 中等查看答案及解析
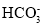 、
、 、
、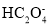 、ClO-、S2-中结合H+的能力最弱的是_____________。
、ClO-、S2-中结合H+的能力最弱的是_____________。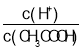 C.
C.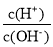 D.c(OH-)
D.c(OH-) N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJ•mol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJ•mol1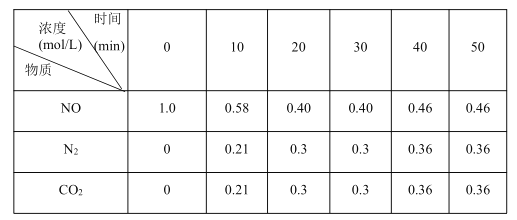
 CaO2。
CaO2。
 在碱性环境下制取CaO2的装置如图所示。
在碱性环境下制取CaO2的装置如图所示。

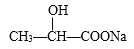
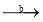
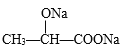 。所用的试剂是a_____________,b_____________(写化学式)。
。所用的试剂是a_____________,b_____________(写化学式)。