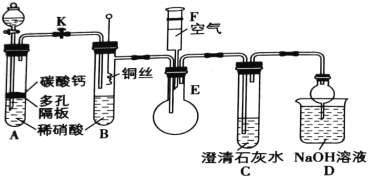
-
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
A.原子半径的大小顺序:rY> rX>rQ>rW
B.X、Y的最高价氧化物的水化物之间不能发生反应
C.Z元素的氢化物稳定性大于W元素的氢化物稳定性
D.元素Q和Z能形成QZ2型的共价化合物
难度: 中等查看答案及解析
-
下列变化过程中,原物质分子内共价键被破坏,同时有离子键形成的是
A.盐酸和氢氧化钠反应 B.氯化氢溶于水
C.溴化氢和氨反应 D.锌和稀硫酸反应
难度: 中等查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:下列说法正确的是 ( )
元素代号
X
Y
Z
M
G
R
Q
原子半径(×10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
0.89
主要化合价
最高正价
+1
+7
+3
+2
+5
--
+2
最低负价
--
-1
--
--
-3
-2
--
A.离子半径r(G3-)﹥r(X+)﹥r(Z3+) B.元素Y和Z形成的化合物为离子化合物
C.R2-比G3-更容易失去电子 D.Y的含氧酸的酸性一定比G的含氧酸的酸性强
难度: 中等查看答案及解析
-
掌握一定的化学知识,疫情期间让你更加安全。下列说法正确的是( )
A.家用消毒液的主要成分是Ca(ClO)2
B.酒精消毒液浓度越高,杀毒效果越好
C.消毒液和洁厕灵混合使用消毒效果更佳
D.据说病毒可以通过气溶胶传播,胶体胶粒直径在1~100nm之间
难度: 中等查看答案及解析
-
下列关于元素周期表的叙述不正确的是( )
A.元素种类最多的族是第ⅢB族 B.元素的最高正化合价均等于它所在的族序数
C.周期表共有 18个纵行16个族 D.在过渡元素区域可以找到耐高温材料,催化剂
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A.N2H4的结构式:
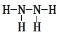 B.Cl–的结构示意图:
B.Cl–的结构示意图:
C.中子数为20的氯原子:17Cl D.NH3的电子式:

难度: 简单查看答案及解析
-
下列关于原电池的说法正确的是( )
A.锌锰干电池中,锌电极作正极
B.原电池中负极金属活动性一定比正极金属强
C.燃料电池与干电池或者蓄电池的主要差别在于反应物不是储存在电池内部
D.氢氧燃料电池是将 H2 和 O2 燃烧所产生的热能转化为电能
难度: 简单查看答案及解析
-
下列说法中错误的是( )
A.浓硫酸可以用来干燥SO2 B.可以用氨气和水来完成喷泉实验
C.浓硝酸应该贮存在棕色试剂瓶中 D.铵盐分解都可以产生氨气,故常用于实验室制氨气
难度: 中等查看答案及解析
-
下列说法错误的是( )
A.相同质量的D2O和H2O含有的电子数之比为9:10
B.
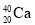 和
和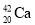 、石墨和金刚石均互为同位素
、石墨和金刚石均互为同位素C.
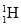 、
、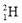 、
、 和H2是氢元素的四种不同粒子
和H2是氢元素的四种不同粒子D.12C和14C互为同位素,物理性质不同,但化学性质几乎完全相同
难度: 简单查看答案及解析
-
下图是某校实验小组设计的一套原电池装置,下列有关描述 不正确的是( )
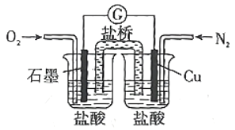
A.石墨的电极反应:
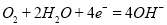
B.此装置能将化学能转变为电能
C.电子由
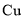 电极经导线流向石墨电极
电极经导线流向石墨电极D.电池总反应:
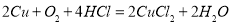
难度: 中等查看答案及解析
-
已知短周期元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径:A>B>D>C B.原子序数:d>c>b>a
C.离子半径:C>D>B>A D.单质的还原性:A>B>D>C
难度: 简单查看答案及解析
-
下列叙述中正确的是( )
A.金属Na与O2在加热时有Na2O2生成,可以推断Li与O2在加热时有Li2O2生成
B.非金属性F>Cl,F2可以从NaCl溶液中置换出Cl2
C.HF的沸点在同族元素的氢化物中出现反常,是因为HF分子间存在氢键
D.SO2能使酸性高锰酸钾溶液褪色体现了其漂白性
难度: 中等查看答案及解析
-
X(g)+3Y(g)
 2Z(g) ΔH=-akJ·mol-1。一定条件下,将1 molX和3 molY通入2L的恒容密闭容器,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1。一定条件下,将1 molX和3 molY通入2L的恒容密闭容器,反应10 min,测得Y的物质的量为2.4 mol。下列说法正确的是( )A.10 min内,Y的平均反应速率为0.03 mol·L-1·s-1
B.10 min内,消耗0.2 molX,生成0.4 molZ
C.第10 min时,X的反应速率为0.01 mol·L-1·min-1
D.10 min内,X和Y反应放出的热量为a kJ
难度: 中等查看答案及解析
-
已知:①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.6 kJ·mol-1
②2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH2=-1452 kJ·mol-1
③H+(aq)+OH-(aq)=H2O(l) ΔH3=-57.3 kJ·mol-1
下列说法正确的是( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.
 H2SO4(aq)+
H2SO4(aq)+ Ba(OH)2(aq)=
Ba(OH)2(aq)= BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+131.4 kJ·mol-1
难度: 中等查看答案及解析
-
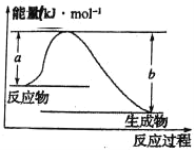
反应A+B→C分两步进行:①A+B→X,②X→C,反应过程中能量变化如图所示,E1表示反应A+B→X的活化能。下列有关叙述正确的是( )
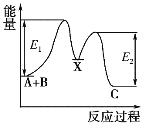
A.E2表示反应X→C的活化能
B.X是反应A+B→C的催化剂
C.反应A+B→C的ΔH<0
D.加入催化剂可改变反应A+B→C的焓变
难度: 中等查看答案及解析
-
在恒温恒容的容器中发生反应 PCl3(g) + Cl2(g)⇌ PCl5(g),下列选项表明反应一定已达平衡状态的是( )
A.容器内压强不再发生变化 B.容器内温度不再发生变化
C.容器内各气体的浓度相等 D.相同时间内消耗 1 mol PCl3,同时断开 1 molCl—Cl 键
难度: 简单查看答案及解析
-
某温度下,体积一定的密闭容器中进行如下反应:
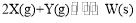 △H>0,下列叙述正确的是( )
△H>0,下列叙述正确的是( )A.在容器中加入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.若将容器的体积压缩,可增大单位体积内活化分子的百分数,有效碰撞次数增大
难度: 简单查看答案及解析
-
少量铁片与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的( )
①加H2O ②加KNO3溶液 ③滴入几滴浓盐酸 ④加入少量铁粉 ⑤加NaCl溶液 ⑥滴入几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发) ⑧改用10 mL 0.1 mol·L-1盐酸
A.①⑥⑦ B.②③⑤⑧ C.③⑦⑧ D.③④⑥⑦⑧
难度: 中等查看答案及解析
-
一种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是( )
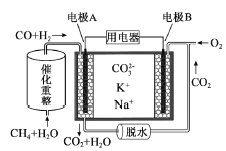
A.反应
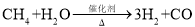 ,每消耗1mol CH4转移12mol 电子
,每消耗1mol CH4转移12mol 电子B.电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O
C.电池工作时,CO32-向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e-=2CO32-
难度: 中等查看答案及解析
-
控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是:
选项
A
B
C
D
装
置
图
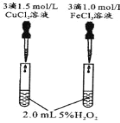

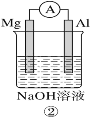
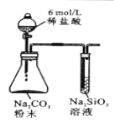
现
象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
镁电极上有气泡冒出,铝极溶解
试管中液体变浑浊
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
金属性:Al>Mg
非金属性:C>Si
A.A B.B C.C D.D
难度: 中等查看答案及解析
 O2(g)=H2O(g) △H=-241.8 kJ·mol-1,x=______________;若忽略温度和压强对反应热的影响,当反应中有1 mol电子转移时,反应的热量变化为______________
O2(g)=H2O(g) △H=-241.8 kJ·mol-1,x=______________;若忽略温度和压强对反应热的影响,当反应中有1 mol电子转移时,反应的热量变化为______________