-
化学与人类生产、生活密切相关,下列说法正确的是
A.纯银器在空气中久置变黑是因为发生了电化学腐蚀
B.世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命
C.绿色化学提倡化工生产应提高原子利用率,原子利用率表示目标产物的质量与生成物总质量之比
D.有机玻璃受热软化,易于加工成型,是一种硅酸盐材料
难度: 简单查看答案及解析
-
下列实验中,无明显现象的是
A.CO2通入CaCl2溶液中 B.NO2通入FeSO4溶液中
C.NH3通入A1C13溶液中 D.SO2通入Ba( NO3)2溶液中
难度: 中等查看答案及解析
-
下列说法不正确的是
①离子化合物一定含离子键,也可能含极性键或非极性键
②共价化合物一定含共价健,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定有共价键
⑥熔融状态下能导电的化合物一定是离子化合物
A.①③⑥ B.②④⑤ C.②③④ D.①③⑥
难度: 简单查看答案及解析
-
下列关于化学基本概念的几点认识中正确的是
A.胶体区别于其他分散系的本质特征是丁达尔效应
B.
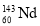 和
和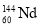 互为同位素
互为同位素C.强电解质溶液的导电能力强于弱电解质溶液
D.SiO2可表示二氧化硅的分子式
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,0.5molHF的体积约为11.2L
B.常温常压下,2molNa2O2与足量SO2反应,转移电子的数目为2NA
C.1molFe与1molCl2反应,转移的电子数为2NA
D.5.6g铁粉与硝酸反应失去的电子数一定为0.2NA
难度: 简单查看答案及解析
-
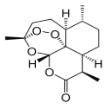
柠檬烯是一种天然的功能单萜,在食品中作为香料添加剂被广泛使用,其结构简式为
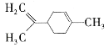 。下列有关柠檬烯的分析不正确的是
。下列有关柠檬烯的分析不正确的是A.1mol柠檬烯完全燃烧消耗14mol O2
B.分子中所有碳原子不可能在同一平面上
C.柠檬烯属于芳香烃
D.一定条件下,柠檬烯可以发生加成反应、取代反应、氧化反应
难度: 简单查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,下列说法中不正确的是
A.2molFeSO4发生反应时,共有8mol电子发生转移
B.Na2FeO4既是氧化产物又是还原产物
C.Na2FeO4处理水时,既能杀菌,又能在处理水时产生胶体净水
D.Na2O2在上述反应中即作氧化剂又作还原剂
难度: 中等查看答案及解析
-
已知下表均为烷烃分子的化学式,且它们的一氯取代物只有一种。则第7项烷烃分子的化学式为
1
2
3
4
5
6
……
CH4
C2H6
C5Hl2
C8H18
C17H36
…
…
A.C53H108 B.C26H54 C.C17H36 D.C16H34
难度: 简单查看答案及解析
-
关于下列各装置图的叙述中,正确的是 ( )
A.
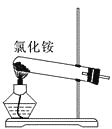 实验室制取氨气
实验室制取氨气B.
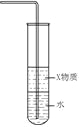 装置中X若为苯,可用于吸收氨气,并防止倒吸
装置中X若为苯,可用于吸收氨气,并防止倒吸C.
 用于制备氢氧化亚铁并观察其颜色
用于制备氢氧化亚铁并观察其颜色D.
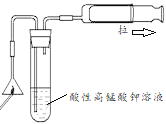 用于检验火柴头燃烧产生的SO2
用于检验火柴头燃烧产生的SO2难度: 中等查看答案及解析
-
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-和
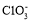 的物质的量浓度之比为7:5则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为
的物质的量浓度之比为7:5则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为A.8:3 B.5:2 C.2:3 D.4:1
难度: 中等查看答案及解析
-
下列有关的说法中,正确的是
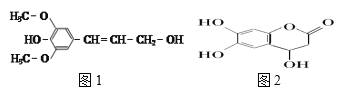
A.分子式为C7H16的烷烃,含有3个甲基的同分异构体有2种
B.分子式为C7H12O4,其中只含二个-COOCH3基团的同分异构体(不考虑手性异构)共有4种
C.芥子醇的结构简式如图1该分子中有5种官能团
D.图2化合物能使酸性高锰酸钾溶液褪色,且1mol最多可与4mol氢气发生反应
难度: 简单查看答案及解析
-
向含大量的K+,Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
A.Na+、Br-、
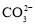 B.Al3+、H+、
B.Al3+、H+、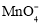
C.
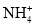 、Fe2+、
、Fe2+、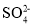 D.Ag+、Cu2+、
D.Ag+、Cu2+、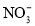
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.氯化铁溶液中通入硫化氢气体2Fe3++S2-=2Fe2++S↓
B.碳酸钡中加入稀硫酸BaCO3+2H+=Ba2++CO2↑+H2O
C.偏铝酸钠溶液中加入碳酸氢钠溶液H2O+
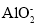 +
+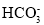 =Al(OH)3↓+
=Al(OH)3↓+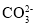
D.碳酸氢铵溶液中加入过量氢氧化钠溶液
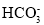 +OH-=
+OH-=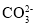 +H2O
+H2O难度: 简单查看答案及解析
-
下列化学实验操作及其结论均正确的是
选项
实验操作及现象
实验结论
A
铝箔在酒精灯上加热熔化但不滴落
铝箔表面氧化铝熔点低于铝
B
向某溶液中加入氯化钡有白色沉淀,再加盐酸沉淀不溶解
溶液中一定有
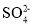
C
将饱和的氯水滴到淀粉碘化钾试纸上试纸先变蓝后变白
氯水具有漂白性
D
将氯化钠溶于水形成饱和溶液,溶于酒精形成胶体
同一物质溶于不同分散剂时,形成不同分散系
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A的pKa1=1.85,pKa2=7.19用0.1mol·L-1NaOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。下列说法不正确的是
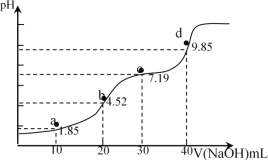
A.a点所得溶液中;2n(H2A)+n(A2-)=0.002mol
B.b点所得溶液中:c(H2A)+c(H+)=c(A2-)+c(OH-)
C.c点所得溶液中:c(Na+)>3c(HA-)
D.d点所得溶液中:c(Na+)>c(HA-)>c(A2-)
难度: 困难查看答案及解析
-
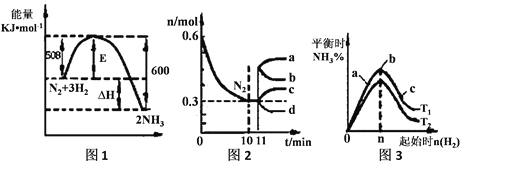
目前废水处理中的除氮技术,通常是把水中的氨氮污染物先降解为
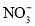 或
或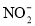 ,然后再用电解的方法除去
,然后再用电解的方法除去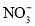 和
和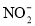 ,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是
,如图是电化学降解硝酸盐的原理,关于该原理的说法正确的是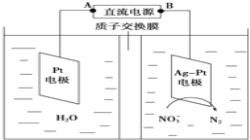
A.若以铅蓄电池做电源进行电解,Pt电极为阴极
B.电解过程中H+向左移动
C.理论上电解过程中阴、阳两极产生的气体在相同条件下体积比为2:5
D.若电解过程中转移1mol电子,则交换膜两侧电解液的质量变化差为7.4g
难度: 中等查看答案及解析
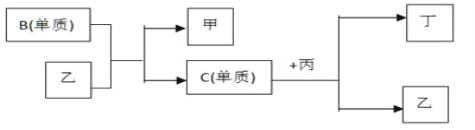
 +OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构________(填字母代号)。
+OH-,试判断NH3溶于水后形成的NH3•H2O的合理结构________(填字母代号)。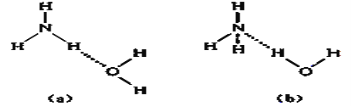

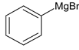 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)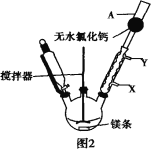
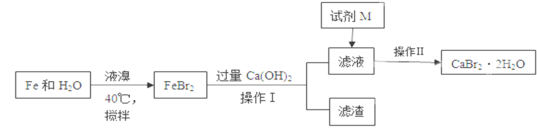
 三苯甲醇。其中,操作①为:__________;洗涤液最好选用:________。
三苯甲醇。其中,操作①为:__________;洗涤液最好选用:________。