-
化学与生产、生活密切相关。下列说法不正确的是
A.焊接金属时常用NH4Cl溶液作除锈剂
B.泡沫灭火器可用于一般起火,但不适用于电器起火
C.电热水器用镁棒防止内胆银腐蚀,原理是外加电流的阴极保护法
D.碘酒可用于皮肤外用消毒
难度: 简单查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是
A.1L0.1mol/LNa2S溶液中S2-和H2S的数目之和小于0.1NA
B.反应3H2(g)+N2(g)
 2NH3(g)△H=-92kJ/mol,当放出9.2kJ热量时,转移电子0.3NA
2NH3(g)△H=-92kJ/mol,当放出9.2kJ热量时,转移电子0.3NAC.电解精炼粗铜,阳极溶解铜6.4g时,阴极得电子数目为0.2NA
D.0.1molFeCl3完全水解形成Fe(OH)3胶体的胶粒数为0.1NA
难度: 中等查看答案及解析
-
下列离子方程式表达正确的是
A.在Ba(OH)2溶液中滴加NaHSO4溶液至pH=7:Ba2++OH-+H++
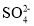 =BaSO4↓+H2O
=BaSO4↓+H2OB.用惰性电极电解硝酸银溶液:4Ag++2H2O
 4Ag+4H++O2↑
4Ag+4H++O2↑C.可用纯碱溶液清洗油污其原因是:
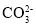 +2H2O
+2H2O H2CO3+2OH-
H2CO3+2OH-D.硫化钠的水解反应:S2-+H3O+
 HS-+H2O
HS-+H2O难度: 中等查看答案及解析
-
化学是一门以实验为基础的学科,掌握基本实验方法和操作技能是做好化学实验的基础。关于下列叙述中,正确的是
A.用玻璃棒蘸取0.lmo/LNaOH溶液滴在湿润的pH试纸中央,与标准比色卡对比,读出pH为13
B.贮存FeCl3溶液,要在溶液中加入少量硫酸
C.向1mL0.1mo/LMgCl2溶液中滴加1mL0.2mol/LNaOH溶液,产生白色沉淀,再滴加2滴0.lmol/LFeCl3溶液,白色沉淀再变为红褐色
D.电镀铜实验时,应该把待镀铁制品与电源正极相连
难度: 中等查看答案及解析
-
根据下列操作及现象,所得结论正确的是
序号
操作及现象
结论
A
将pH相等的盐酸和醋酸溶液稀释相同倍数后,醋酸导电能力强
醋酸溶液中存在电离平衡
B
常温下,测得0.1mol/LNa2CO3溶液的pH大于0.1mol/LNaHCO3溶液
常温下水解程度:
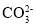 <
<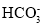
C
室温下,用pH试纸测定浓度为0.1mol/LNaClO溶液和0.1mnol/LCH3COONa溶液的pH
比较HClO比CH3COOH的酸性弱
D
将固体CaSO4加入Na2CO3溶液中,一段时间后,检验固体成分为CaCO3
同温下溶解度:CaSO4<CaCO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.25℃时,0.1mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力强
B.pH=10的Ba(OH)2溶液与氨水,溶质的物质的量浓度之比为1:2
C.加热蒸干并灼烧AlCl3溶液得到Al2O3固体
D.将CH3COONa溶液从20℃升温至30℃,溶液中
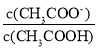 增大
增大难度: 中等查看答案及解析
-
下列说法正确的一组是
①等体积等浓度的NaOH溶液中和相同浓度的盐酸和醋酸两溶液,两溶液消耗的体积一样多
②在500℃、20MPa条件下,在5L密闭容器中进行合成氨的反应,使用催化剂后K增大
③S(g)+O2(g)=SO2(g)可用该反应的△H表示燃烧热
④向醋酸钠溶液中加入醋酸使溶液的pH=7,此时混合液中c(Na+)>c(CH3COO-)
⑤CO(g)+2H2(g)
 CH3OH(g)△H=-90.7kJ/mol,将1molCO(g)和2molH2(g)充分反应,反应放出的能量小于90.7kJ
CH3OH(g)△H=-90.7kJ/mol,将1molCO(g)和2molH2(g)充分反应,反应放出的能量小于90.7kJ⑥pH=3的盐酸与pH=3的醋酸溶液中,水电离的c(H+)相同
A.②③⑥ B.①③④ C.①④⑥ D.①⑤⑥
难度: 中等查看答案及解析
-
根据下列图示所得出的结论正确的是

A.由图1表示燃料燃烧反应的能量变化
B.若图2表示常温下用0.0001mol/LNaOH溶液滴定25.00mLCHCOOH溶液的滴定曲线,则c(CH3COOH)=0.0001mol/L
C.若图3为1mLpH=2某一元酸溶液加水稀释时pH随溶液总体积的变化曲线,则说明该酸是强酸
D.由图4知反应3A(g)+2B(g)
 2C(g)的△H>0,且a=1.5
2C(g)的△H>0,且a=1.5难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使甲基橙变红的溶液中:Fe2+、
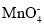 、
、 、Na+、
、Na+、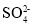
B.
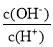 =10-12mol.L-1的溶液中:
=10-12mol.L-1的溶液中: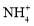 、Ca2+、Cl-、
、Ca2+、Cl-、
C.pH=11的溶液中:K+、Al3+、
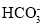 、
、
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:Na+、
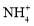 、Cl-、
、Cl-、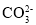
难度: 中等查看答案及解析
-
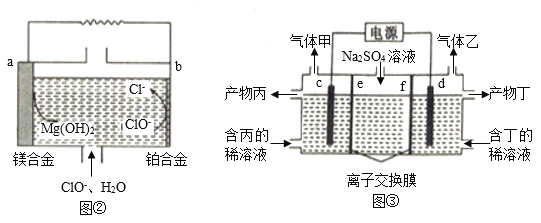
如图所示的装置,C、D、E、F是惰性电极。甲中是硫酸铜溶液、乙中是饱和氯化钠溶液,将电源接通后,在F极附近能产生使湿润淀粉-KI试纸变蓝的气体。则以下说法正确的是

A.A极是电源正极
B.丙装置给锌镀银,G应该是Ag,电镀液是AgNO3溶液
C.甲、乙装置的D、E电极均有单质生成,其物质的量之比为1:2
D.装置丁的X极是铁,电解液是硫酸钠溶液,丁中可得到白色的Fe(OH)2沉淀
难度: 简单查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.20mL0.1000mol/L氨水用0.1000mol/L的盐酸滴定,当滴入盐酸达30mL时,溶液中:c(
 )+c(H+)<c(OH-)+c(Cl-)
)+c(H+)<c(OH-)+c(Cl-)B.0.1mol/L的NaHX溶液pH为4,该溶液中:c(HX-)>c(H2X)>c(X2-)>c(H+)>c(OH-)
C.在Na2S稀溶液中,c(OH-)=c(H+)+2c(H2S)+c(HS-)
D.0.1mol/L(NH4)2Fe(SO4)2溶液:c(
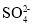 )>c(
)>c( )>c(H+)>c(Fe2+)
)>c(H+)>c(Fe2+)难度: 困难查看答案及解析
-
一定温度下在一个2L的恒容密闭容器中发生反应4A(s)+3B(g)
 2C(g)+D(g)△H>0,经2min达平衡状态,此时B反应消耗了0.3mol,下列说法正确的是
2C(g)+D(g)△H>0,经2min达平衡状态,此时B反应消耗了0.3mol,下列说法正确的是A.平衡后加入C,上述反应的△H减小
B.减少少量A,逆反应速率减小
C.充入惰性气体使压强增大可加快反应速率
D.当容器中气体的密度不再改变时,反应达到平衡
难度: 中等查看答案及解析
-
电解NO制备NH4NO3的工作原理如图所示,为使电解产物全部转化为NH4NO3,需要补充物质M是NH3。下列有关分析或说法中正确的是
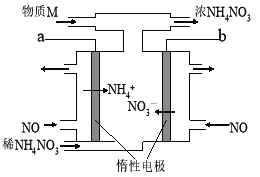
A.电子的流向:a电源负极→稀NH4NO3溶液→b电源正极
B.阳极NO发生还原反应生成硝酸根离子
C.阴极的电极反应式:NO+5e-+6H+=
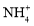 +H2O
+H2OD.电路中通过1.5mol电子时,理论上最多可处理8.96LNO气体(标准状况)
难度: 中等查看答案及解析
-
溶液中的反应
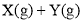
 分别在①、②、③三种不同实验条件下进行,它们的起始浓度为
分别在①、②、③三种不同实验条件下进行,它们的起始浓度为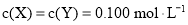 及
及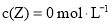 ,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是( )
,反应物X的浓度随时间变化如图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是( )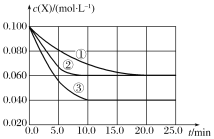
A.反应进行到
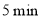 时实验③的反应速率最快
时实验③的反应速率最快B.条件②的反应最先达到平衡
C.②与①比较可能是压强更大
D.该反应的正反应是吸热反应
难度: 中等查看答案及解析
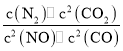 ,请写出此反应的热化学方程式________。
,请写出此反应的热化学方程式________。 N2(g)+CO2(g)△H。
N2(g)+CO2(g)△H。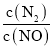 恒定
恒定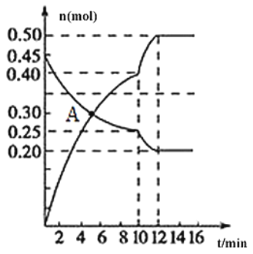
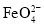 +3H2↑。
+3H2↑。
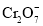 )。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=________(已知Ksp[Cr(OH)3]=1.0×10-32)
)。处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-8mol/L时,Cr3+沉淀完全,此时溶液的pH=________(已知Ksp[Cr(OH)3]=1.0×10-32)