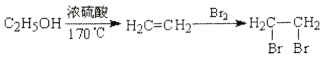-
下列说法正确的是
A.“天宫二号”空间实验室的太阳能电池板的主要材料是二氧化硅
B.明矾溶于水后,发生水解可制得Al(OH)3胶体,用于杀菌消毒
C.海水是巨大的资源宝库,可以利用化学方法从海水中提取Br、Mg等物质
D.棉花、合成纤维、蚕丝和人造毛的主要成分都是纤维素
难度: 简单查看答案及解析
-
下列对化学用语的理解中正确的是
A.D2O与H2O互为同分异构体
B.向Na2CO3溶液中滴入酚酞溶液,溶液变红:CO
 +2H2O
+2H2O  H2CO3+2OH-
H2CO3+2OH-C.质子数是35、中子数是45的溴原子:
 Br
BrD.3-甲基-1-丁烯的结构简式:(CH3)2CH=CHCH3
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.NA个Al(OH)3胶体粒子的质量为78g
B.12g金刚石中含有C-C键数为4NA
C.标准状况下,2.24L 三氧化硫中所含分子数约为0.1NA
D.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
难度: 中等查看答案及解析
-
短周期中8种元素a-h,其原子半径、最高正化合价或最低负化合价随原子序数递增的变化如图所示,
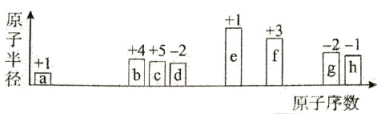
下列判断不正确的是
A.a、d、f组成的化合物能溶于强碱溶液
B.简单离子的半径: e>g
C.a可分别与g或h组成含18个电子的分子
D.最高价氧化物对应水化物的酸性: h>g>b
难度: 简单查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入FeCl3溶液中
②少量Ca(OH)2投入过量NaHCO3溶液中
③向饱和Na2CO3溶液中通入足量CO2
④向AlCl3溶液中滴入NaHCO3溶液
⑤过量NaOH溶液和明矾溶液混合
A.②③④ B.①②④ C.①②③ D.③④⑤
难度: 困难查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.将氯气溶于水制备次氯酸: Cl2+H2O = 2H+ Cl-+ ClO-
B.Na2O2与H2O反应制备O2: Na2O2+H2O = 2Na++ 2OH-+ O2↑
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO
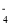 + 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2O
+ 6H++ 5H2O2 = 2Mn2++ 5O2↑+ 8H2OD.用FeCl3溶液腐蚀铜线路板: Cu+2Fe3+ = Cu2+ +2Fe2+
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是
A.澄清透明的溶液: K+、H+、SO
 、MnO
、MnO
B.0.1mol/L FeCl3溶液: Ba2+、Al3+、SCN-、Cl-
C.0.1 mol/L NaClO溶液: Na+、NH
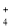 、CO
、CO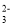 、SO
、SO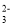
D.
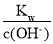 =0.1 mol/L的溶液: Na+、K+、AlO
=0.1 mol/L的溶液: Na+、K+、AlO 、Br-
、Br-难度: 简单查看答案及解析
-
下表为各物质中所含有的少量杂质以及除去这些杂质应选用的试剂或操作方法,正确的一组为
序号
物质
杂质
选用的试剂或操作方法
A
Al2(SO4)3溶液
MgSO4
加入过量烧碱后过滤,再用硫酸酸化滤液
B
FeCl3
CaCO3
溶解、过滤、蒸发结晶
C
CCl4
Br2
用NaOH溶液洗涤、分液
D
CO2
SO2
通过盛有品红溶液的洗气瓶,再通过盛有浓硫酸的洗气瓶
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图。下列说法错误的是
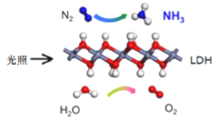
A.上述合成NH3的过程属于氮的固定
B.该过程的化学方程式为: 2N2+6H2O
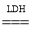 4NH3+3O2
4NH3+3O2C.该过程中涉及极性键和非极性键的断裂与生成
D.在该合成氨反应条件下,每转移2NA个电子需要22.4L的H2O
难度: 中等查看答案及解析
-
某有机物的结构简式如下图所示,下列关于该有机物的说法错误的是

A.该有机物的含氧官能团有3种
B.1mol该有机物能与3 mol H2发生加成反应
C.该有机物既能与酸反应又能与碱反应
D.该有机物能使溴的四氯化碳溶液褪色
难度: 中等查看答案及解析
-
下列有关同分异构体数目的叙述,不正确的是
A.分子组成是C4H8O且属于醛的同分异构体有2种
B.C8H10中只有4种属于芳香烃的同分异构体
C.甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D.C5H8O2中既能使指示剂变色又能够与溴的四氯化碳溶液反应的有机物有10种
难度: 中等查看答案及解析
-
聚碳酸酯高分子材料PC的透光率好,可制作车、船、飞机的挡风玻璃,以及眼镜镜片、光盘、唱片等,其合成反应为:

下列说法不正确的是
A.W是甲醇
B.
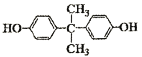 的分子式为C15H18O2
的分子式为C15H18O2C.
 的核磁共振氢谱有4个吸收峰
的核磁共振氢谱有4个吸收峰D.合成PC的反应为缩聚反应
难度: 中等查看答案及解析
-
下列实验现象及对应得出的结论均正确的是
操作及现象
结论
A
向AgCl悬浊液中加入NaI溶液时出现黄色沉淀。
Ksp(AgCl)< Ksp(AgI)
B
将浓硫酸滴到胆矾晶体表面,晶体表面出现白斑
浓硫酸具有脱水性
C
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色。
Br-还原性强于Cl-
D
加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结。
NH4Cl固体可以升华
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
金属铬常用于提升特种合金的性能。工业上以铬铁矿(主要成份为FeO·Cr2O3,含有少量Al2O3)为原料制备金属铬的流程如下图。下列说法不正确的是( )
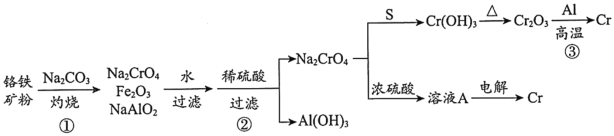
A.①中需持续吹入空气作氧化剂 B.②中需加入过量稀硫酸
C.③中发生了置换反应 D.溶液A为橙色
难度: 中等查看答案及解析
-
某化学学习小组利用如图装置来制备无水AlCl3 (已知:无水AlCl3,178
 C升华,遇水能迅速发生反应)。下列说法正确的是
C升华,遇水能迅速发生反应)。下列说法正确的是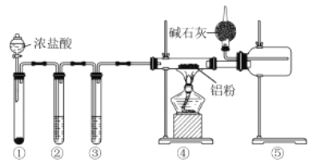
A.装置④和⑤之间使用粗玻璃管是为了防堵塞
B.装置②、③中的试剂分别为浓硫酸、饱和食盐水
C.装置①中的试剂是二氧化锰MnO2
D.球形干燥管中碱石灰的作用只是处理尾气
难度: 简单查看答案及解析
-
实验小组同学探究FeSO4分解反应并检验反应产物(加热及加持装置略)。下列有关FeSO4分解的说法不正确的是( )
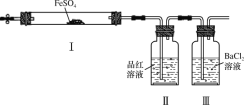
A.Ⅰ中固体变为红棕色,说明反应生成了Fe2O3
B.Ⅰ中反应需持续加热,说明FeSO4分解是吸热反应
C.Ⅱ中品红溶液颜色褪去,说明反应生成了SO2
D.Ⅲ中未产生白色沉淀,说明反应未生成SO3
难度: 中等查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡Sn,发生反应: Sn(s)+Pb2+(aq)⇌Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。
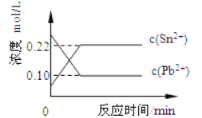
下列判断正确的是
A.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
B.25℃时,该反应的平衡常数K=2.2
C.平衡体系中加入金属铅后,c(Pb2+)增大
D.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
难度: 简单查看答案及解析
-
25°C时,向50 mL浓度均为1.0 mol/L的醋酸和醋酸钠混合溶液中,缓慢滴加1.0 mol/L的NaOH溶液,所得溶液的pH变化情况如图所示(已知: 25°C时,Ka(CH3COOH) =1.8×10—5)。下列叙述错误的是
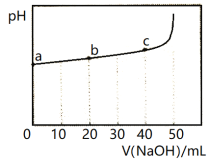
A.V(NaOH)≤50mL时,随V(NaOH)增大,溶液中离子总浓度增大
B.b点溶液中,c(Na+)>c(CH3COOH)
C.a点溶液中,c(H+)约为1.8×10-5 mol/L
D.从a到c的过程中,溶液中
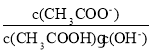 不变
不变难度: 困难查看答案及解析
-
“84”消毒液 (主要成分为NaClO)广泛应用于杀菌消毒。某化学学习小组用甲烷燃料电池电解饱和食盐水制备“84”消毒液,装置如图所示,a、b、c、d 均为惰性电极,下列说法正确的是
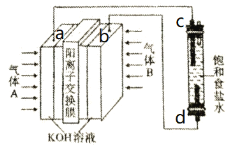
A.c是阳极
B.甲烷发生的电极反应方程式为CH4-8e-+8OH-=CO2↑+6H2O
C.消耗2.24L (标准状况)甲烷,K+通过交换膜向左室移动0.8 mol
D.电解装置中的总反应为NaCl+H2O
 NaClO+H2↑
NaClO+H2↑难度: 困难查看答案及解析
-
t℃时,两种碳酸盐MCO3(M表示X2+或Y2+)的沉淀溶解平衡曲线如图所示。已知:
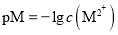 ,
, ,
,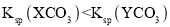 。
。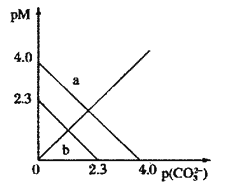
下列说法正确的是( )
A.线a表示YCO3的溶解平衡曲线
B.
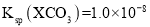
C.t℃时,向XCO3悬浊液中加入饱和
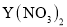 溶液,可能有YCO3生成
溶液,可能有YCO3生成D.t℃时,向饱和YCO3溶液中加入Na2CO3溶液,一定能产生YCO3沉淀
难度: 中等查看答案及解析
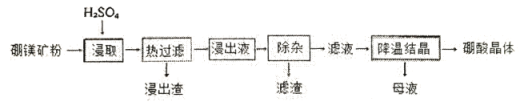
 , 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是_____________; H2O2的作用是___________________(用离子方程式表示)。
, 还含有Fe3+、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO, 除去的杂质离子是_____________; H2O2的作用是___________________(用离子方程式表示)。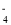 + 8H+= 5Fe3+ + Mn2+ + 4H2O
+ 8H+= 5Fe3+ + Mn2+ + 4H2O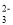 =2I-+S4O
=2I-+S4O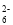 常用于精盐中碘含量测定。
常用于精盐中碘含量测定。 和CrO
和CrO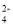 , 它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
, 它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。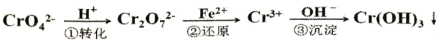
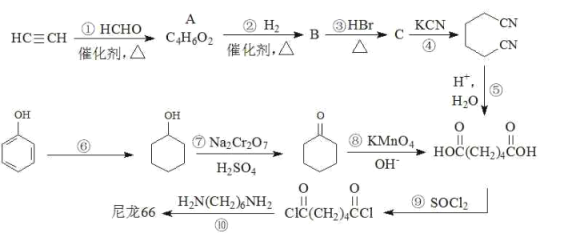
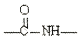 结构片段,请写出反应⑩的化学反应式________________________
结构片段,请写出反应⑩的化学反应式________________________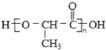 )是一种生物可降解材料,已知羰基化合物可发生下述反应:
)是一种生物可降解材料,已知羰基化合物可发生下述反应: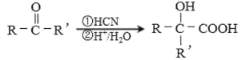 (R'可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程(注明反应条件,无机试剂任选)。
(R'可以是烃基或H原子)。用合成路线图表示用乙醇制备聚乳酸的过程(注明反应条件,无机试剂任选)。