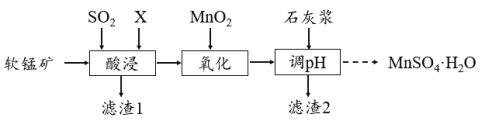
-
2020年7月1日,世界首座跨度超千米的公铁两用斜拉桥--沪苏通长江公铁大桥胜利开通。大桥的开通为长三角一体化发展国家战略奠定了坚实的基础。下列有关大桥设施的说法不正确的是

A.桥上层公路铺设的沥青主要成分为焦炭
B.桥下层铁路铺设的钢轨是一种铁合金
C.桥栏杆涂油漆兼具美观和防止金属生锈的功能
D.桥索上的彩色灯光与原子核外电子的跃迁有关
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.羟基的电子式:
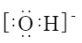
B.聚丙烯的结构简式:
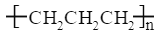
C.氨基乙酸的分子式:C2H5NO2
D.乙酸的球棍模型:
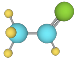
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.烧碱和纯碱均属于碱
B.水煤气和天然气均属于纯净物
C.裂化汽油和直馏汽油均属于烃类
D.
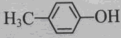 和
和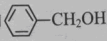 均属于酚
均属于酚难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A.油脂难溶于水,可用于工业生产肥皂
B.硫酸钠能使蛋白质盐析,可用于分离蛋白质
C.甲醛能发生银镜反应,可用于浸制生物标本
D.纤维素能水解得到葡萄糖,可用于制醋酸纤维
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液:Na+、K+、HCO
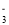 、SO
、SO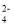
B.使酚酞变红色的溶液:NH
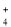 、Ca2+、NO
、Ca2+、NO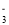 、SO
、SO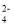
C.0.1mol·L-1 K2CO3溶液:H+、Ba2+、NO
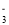 、Cl-、
、Cl-、D.0.1mol·L-1FeCl3溶液:Na+、Cu2+、SO
 、NO
、NO
难度: 中等查看答案及解析
-
下列说法正确的是
A.0.3g 3He含有0.1mol中子
B.0.1mol·L-1NaCl溶液中含有0.1mol Na+
C.标准状况下, 1.12 L 水中含有 0. 1mol H
D.常温常压下,2.8gN2 中含有 01 mol π键
难度: 中等查看答案及解析
-
下列有关实验装置正确且能达到实验目的的是
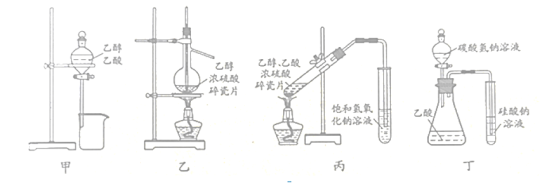
A.装置甲:分离乙醇和乙酸
B.装置乙:实验室制备少量乙烯
C.装置丙:制取少量乙酸乙酯
D.装置丁:比较乙酸、碳酸、硅酸三者酸性强弱
难度: 简单查看答案及解析
-
核酸检测为确认病毒感染提供了关键的支持性证据。某核糖核酸(RNA)的结构片断示意图如下, 它在酶的催化作用下能完全水解生成戊糖、碱基和某酸。下列说法不正确的是
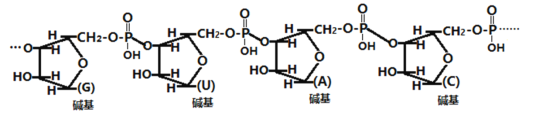
A.核酸也可能通过人工合成的方法得到
B.酶是有机化合物,催化活性与温度有关
C.该核酸水解生成的碱基中含有氮元素
D.该核酸完全水解生成的酸是H3PO3
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Na2O2与水反应:2O
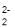 +2H2O= 4 OH-+ O2↑
+2H2O= 4 OH-+ O2↑B.向苯酚钠溶液中通入少量 CO2:C6H5O-+ CO2+ H2O→C6H5OH + HCO
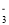
C.向碳酸氢铵溶液中加入足量石灰水: Ca2+ +HCO
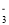 +OH-=CaCO3↓+ H2O
+OH-=CaCO3↓+ H2OD.用NaOH溶液吸收 NO2:4 NO2+4 OH-=3 NO
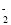 +NO
+NO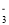 +2H2O
+2H2O难度: 中等查看答案及解析
-
双氧水和“84”消毒液都可以有效杀灭新冠病毒, 常温下将两者混合时可发生反应: NaClO+ H2O2 =NaCl+O2↑+H2O。 下列有关说法正确的是
A.该反应属于置换反应
B.常温下,H2O2 的氧化性强于 NaClO
C.H2O2在该反应中既作氧化剂又作还原剂
D.生成1.12 L (标准状况)O2 时共转移 0.1 mol 电子
难度: 简单查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
将Na2SO3样品溶于水,加入硝酸酸化的Ba(NO3)2溶液,有白色沉淀产生
Na2SO3样品中含有Na2SO4
B
向某溶液中滴加KSCN溶液,无明显现象,再滴加氯水后,溶液变红
原溶液中含有Fe2+
C
向溴水中滴加乙醛溶液,溶液褪色
乙醛能与Br2发生加成反应
D
向苯和溴液的混合物中加入铁粉,将气体通入硝酸银溶液中,有淡黄色沉淀产生
苯与Br2发生取代反应
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某一元醇具有如下性质:①能在加热时被 CuO氧化;②能发生消去反应得到烯烃;③生成的烯烃一定不存在顺反异构体。该一元醇可能
A.1—丁醇 B.2—丁醇 C.2,2-二甲基丙醇 D.2-甲基-2-丙醇
难度: 中等查看答案及解析
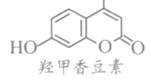
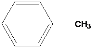 和
和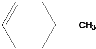 中,鉴别两种有机物
中,鉴别两种有机物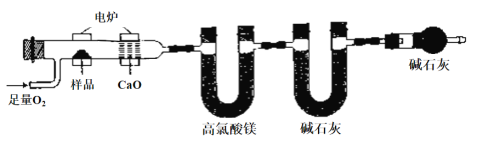
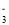 的空间构型为_______(用文字描述)。
的空间构型为_______(用文字描述)。
 )等物质生成。
)等物质生成。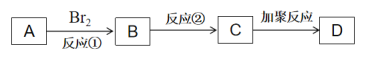
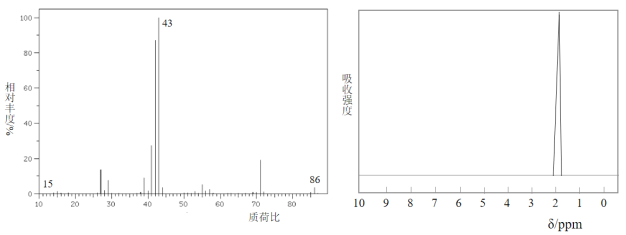
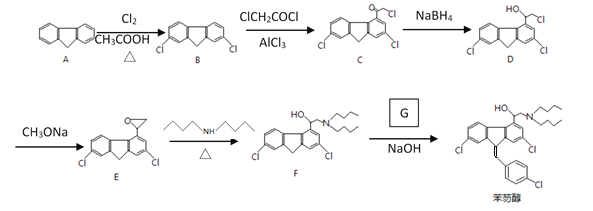
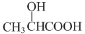
 和ClCH2COCl为原料制备
和ClCH2COCl为原料制备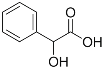 (苦杏仁酸)的合成路线图(无机试剂任用,合成路线流程图示例见本题题干)___。
(苦杏仁酸)的合成路线图(无机试剂任用,合成路线流程图示例见本题题干)___。