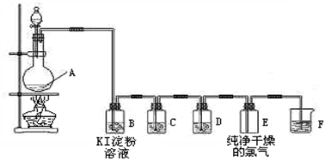
-
已知元素的原子序数,可以推知该元素原子的
①中子数 ②质子数 ③核电荷数 ④质量数 ⑤核外电子数
A.①②③ B.①③⑤ C.②③④ D.②③⑤
难度: 简单查看答案及解析
-
张青莲是我国著名的化学家。1991年,他准确测得In的原子量为114.818,被国际原子量委员会采用为新的标准值。这是原子量表中的首次采用我国测定的原子量值。已知In的原子结构如图所示,则下列关于In的说法不正确的是
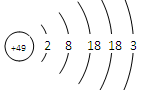
A.In在反应中容易失电子
B.In为长周期元素
C.In的最高价氧化物对应的水化物为强碱
D.In为过渡元素
难度: 困难查看答案及解析
-
1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤–239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤–239的原子核内少54个质子和100个中子,则A元素在元素周期表中的位置是
A.第3周期第IA族 B.第3周期第IIA族
C.第5周期第IA族 D.第4周期第VIIA族
难度: 中等查看答案及解析
-
下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱
B.F2、Cl2、Br2、I2单质的氧化性依次减弱
C.C、N、O原子半径依次增大
D.P、S、Cl最高正价依次升高
难度: 中等查看答案及解析
-
下列反应中,即属于氧化还原反应同时又是吸热反应的是
A.Ba(OH)2·8H2O与NH4Cl反应 B.铝与稀盐酸
C.灼热的炭与CO2反应 D.氢氧化钠溶液与醋酸溶液
难度: 中等查看答案及解析
-
在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是
A.V(NH3)=0.5 mol•L-1•min-1 B.V(H2)=0.3 mol•L-1•min-1
C.V(N2)=0.2 mol•L-1•min-1 D.V(H2)=0.01 mol•L-1• s -1
难度: 中等查看答案及解析
-
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2 + O2
2SO3,这是一个正反应放热的可逆反应。如果反应在密闭容器中进行,下述有关说法不正确的是
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%地转化为SO3
C.化工生产中,可通过改变温度、浓度、压强等因素,提高SO2的转化率
D.达到平衡时,SO2的浓度与SO3的浓度相等
难度: 困难查看答案及解析
-
下述实验设计合理的是
A.用锌粒和稀硝酸反应制备H2
B.用NH4NO3加热制取NH3
C.大理石与稀硫酸反应制备CO2
D.用焰色反应鉴别固体NaCl和 KCl
难度: 中等查看答案及解析
-
可逆反应2NO2
2NO + O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n mol O2 的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
A.①③ B.②③④ C.②③ D.①④
难度: 困难查看答案及解析
-
在恒温恒容的容器中进行反应H2
2H,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.等于12s C.大于18s D.小于18s
难度: 中等查看答案及解析
-
下列说法正确的是
A.核外电子排布相同的微粒,其化学性质也相同
B.含有金属元素和非金属元素的化合物不一定是离子化合物
C.仅含非金属元素的化合物一定是共价化合物
D.凡需要加热的反应一定是吸热反应
难度: 中等查看答案及解析
-
下列有关元素周期表的说法中,错误的是
A.主族元素分布于短周期和长周期里,而副族元素仅分布于长周期里
B.元素周期表中,位于同一主族的元素的原子最外层电子数相同,且等于族序数
C.元素周期表中,周期的序数就是该周期元素原子具有的电子层数
D.元素周期表有7个横行,7个周期;18个纵列,18个族
难度: 简单查看答案及解析
-
元素周期表中短周期的一部分如图,关于X、Y、Z、W、Q说法正确的是

A.元素Y与元素Z的最高正化合价之和的数值等于9
B.原子半径的大小顺序为:W>Z>Y
C.离子半径的大小顺序为:W2->Y2->Z3+
D.W的气态氢化物的热稳定性和还原性均比Q强
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g) 每1molHI生成放出的能量是a kJ.已知:(a、b、c均大于零),下列说法正确的是

A.H2、I2和HI都是共价化合物
B.断开2 mol HI分子中的化学键所需能量约为(c+b+2a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入1 mol H2 (g)和1 mol I2 (g),充分反应后放出的热量为2a kJ
难度: 中等查看答案及解析
-
下列事实中,不能说明氯原子得电子能力比硫原子强的是
A.盐酸的酸性比氢硫酸(H2S水溶液)酸性强
B.Cl2与铁反应生成FeCl3 ,而S与铁反应生成FeS
C.Cl2能与H2S反应生成S
D.还原性:Cl-<S2-
难度: 中等查看答案及解析
-
某温度时,浓度都是1 mol / L的两种气体X2、Y2在密闭容器中反应生成气体Z,达平衡后,c (X2)为0.4 mol / L,c (Y2)为0.8 mol / L,生成c (Z)为0.4 mol / L,则该反应的反应式(z用x、y表示)是
A.X2 + 2Y2
2XY2 B.2X2 + Y2
2X2Y
C.3X2 + Y2
2X3Y D.X2 + 3Y2
2XY3
难度: 中等查看答案及解析