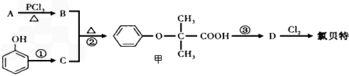
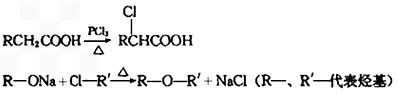-
NA为阿伏加德罗常数的值,下列说法中正确的是
A.1.68gFe和足量水蒸气反应,转移的电子数目为0.09NA
B.由31H和168O组成的超重水11g,其中所含的中子数为6NA
C.1L1mol·L-1的NaClO溶液中含有ClO-的数目为NA
D.1mol白磷(P4)分子中所含共价键数为4NA
难度: 困难查看答案及解析
-
分子式为C6H12O2的酯共有(不考虑立体异构)
A.18种 B.19种 C.20种 D.21种
难度: 困难查看答案及解析
-
下列实验中,对应的现象及结论都正确且两者具有因果关系的是
选项
实验
现象
结论
A
在未知溶液中滴加BaCl2溶液出现白色沉淀,再加稀硝酸
沉淀不溶解
该未知溶液存在SO42-或SO32-
B
向稀的苯酚水溶液中滴加少量溴水
先看到白色沉淀,后消失
生成的三溴苯酚又重新溶于苯酚溶液中
C
向某溶液中加入几滴新制的氯水,再向溶液中加入2滴KSCN溶液
溶液变为红色
该溶液中一定含有Fe2+
D
在相同温度下,向1mL0.2mol·L-1NaOH溶液中滴入2滴0.1mol·L-1MgCl2溶液,再滴加2滴0.1mol·L-1FeCl3溶液
先产生白色沉淀,后生成红褐色沉淀
Ksp[Mg(OH)2]>Ksp[Mg(OH)3]
难度: 困难查看答案及解析
-
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A. 元素A、B组成的化合物常温下一定呈气态
B. 单质沸点:C>D>E
C. 工业上常用电解法制备元素C、D、E的单质
D. 离子半径:r(C)>r(D)>r(E)
难度: 简单查看答案及解析
-
一种新型乙醇电池用磺酸类质子作溶剂,电池总反应为:C2H5OH +3O2→2CO2 +3H2O,电池示意图如下图。下面对这种电池的说法正确的是
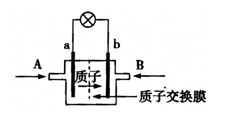
A.A处通氧气,B处通乙醇
B.电池工作时电子由a极沿导线经灯泡再到b极
C.电池正极的电极反应为:O2+2H2O+4e-=4OH-
D.若用这种电池作电源保护金属铁,则a电极连接石墨,b电极连接铁
难度: 简单查看答案及解析
-
下列各表述与示意图一致的是
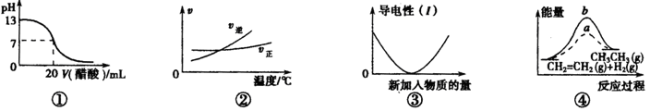
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.根据图②可判断可逆反应A2(g)+3B2(g)
2AB3(g)的△H<0
C.图③可表示向Ba(OH)2溶液中加入Na2SO4溶液至过量时溶液导电性的变化
D.图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) △H>0未使用和使用催化剂时,反应过程中的能量变化
难度: 中等查看答案及解析
-
一定温度下,下列溶液中的粒子浓度关系式正确的是
A.0.1mol·L-1的NaHS溶液中:c(OH-)=c(H+)+c(H2S)
B.往氯化铵溶液中加水
的值变大
C.0.1mol·L-1的NaOH溶液与0.2mol·L的HA溶液等体积混合,所得溶液呈碱性:c(Na+)>c(HA)>c(A-)>c(OH-)>c(H+)
D.pH相等的①NH4Cl ②NH4Al(SO4)2 ③NH4HSO4溶液中,c(NH4+)大小顺序:①>②>③
难度: 困难查看答案及解析

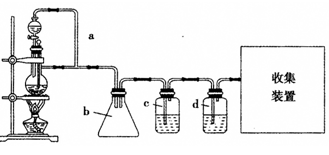
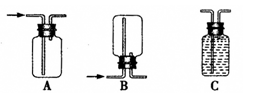
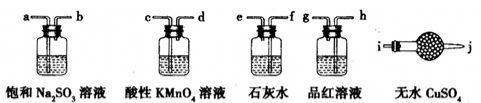
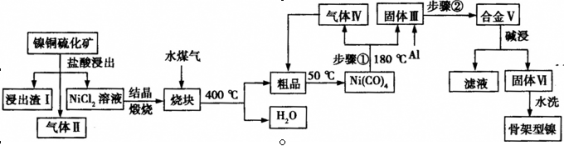
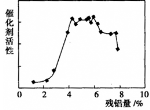
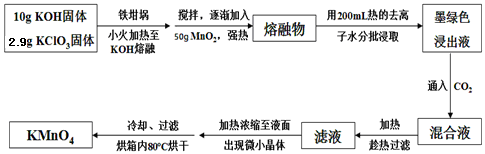
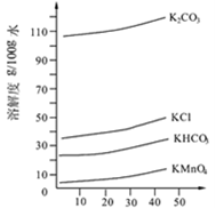
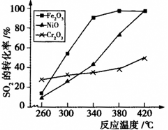
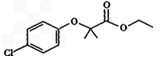 。
。