-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
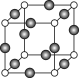
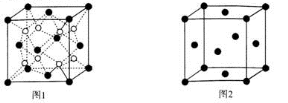
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
高三化学填空题困难题查看答案及解析
-
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
⑴Y、Z、W元素的第一电离能由大到小的顺序是 。
⑵K的二价离子电子排布式是 。
⑶Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是 。
⑷若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
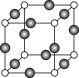
⑸Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。
高三化学填空题困难题查看答案及解析
-
X、Y、Z、W、Q五种元素的原子序数依次增大,X、Y、Z、W属于短周期元素。已知X位于周期表的s区,其原子中电子层数和未成对电子数相同;Y原子核外有三个能级,且每个能级上容纳的电子数相同;W原子最外层电子数是次外层电子数的3倍;Q元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)仅由X与W组成的含18个电子的分子的结构式为___________。
(2)Y、Z、W中第一电离能最大的是_________(填元素符号),Q的基态原子核外电子排布式为________。
(3)YW32-离子的空间构型是________,其中心原子的杂化轨道类型是__________。
(4)已知由Q、Z、W三种元素按照1:3:9的原子个数比可形成某离子化合物,常温下测得该离子化合物的水溶液pH=2,则该溶液中由水电离产生的c(H+)为_________。
(5)Y的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1个这种单质分子中所含π键的数目为____________。
(6)Q元素的单质在形成晶体时,其晶胞如图2所示。则Q原子的配位数为___________,若Q的原子半径为acm,阿伏加德罗常数的值为NA,则该单质的密度为_________g/cm3(不必化简)。
高三化学推断题困难题查看答案及解析
-
已知元素周期表中前四周期的元素a、b、C、d、e、f的原子序数依次增大。a、c的基态原子中均有2个未成对电子,c与d位于同一主族,元素e的基态原子的3d轨道上有2个电子,基态f原子M层有2个未成对电子且位于第Ⅷ族。
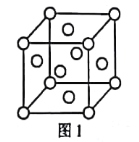
(1)元素e在周期表中的位置为___;f的单质的晶胞结构如图1所示,该晶胞为___堆积。
(2)c元素可分别与a、b元素组成多种简单阴离子,其中中心原子采用sp2杂化,空间构型为平面三角形的离子有___(填离子符号)。一个氢原子与一个a原子、一个b原子组成的分子中σ键和π键的数目之比为___。
(3)基态原子未成对电子数与b相同的前四周期元素中,除了与b同主族的元素外,还有___(填元素符号)。
(4)分子中的大π键可用符号
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
),d元素的低价酸性氧化物其大π键应表示___。
(5)c、f元素形成的一种晶体的晶胞结构如图2所示,其单原子层堆积结构实际如图3所示。
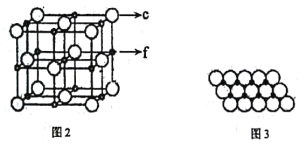
该①晶体的化学式是___。
②如图3中,c离子之间最短核间距为apm,NA表示阿伏加德罗常数的值。则该晶体中1m2单原子层的质量为___(用含a和NA的代数式表示)。
高三化学综合题困难题查看答案及解析
-
现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。已知B元素L层电子数为K层上的2倍,D的原子核外存8种运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)写出D原子基态的价层电子排布图:________。
(2)下列说法错误的是____________(填序号)。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:
B.电负性:
C.
与
互为等电子体,结构相似,化学性质相似
D.稳定性:
,是因为水分子间存在氢键的缘故
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向元素F的硫酸盐溶液中通入过量的气体X(X由C、A两种元素形成的含有10个电子的微粒)可生成
,该离子的结构式为____________(用相关元素符号表示)。
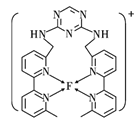
(4)某化合物与F(Ⅰ)(Ⅰ表示元素F的化合价为+1价)结合形成如图所示的离子,该离子中碳原子的杂化方式是_______。
(5)已知
是直线型分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则
中σ键和π键的个数比为____。
(6)C元素最高价含氧酸与硫酸酸性强度相近,原因是_______。
(7)B单质的一种同素异形体的晶胞如图所示:
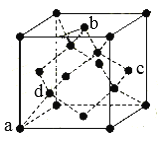
则一个晶胞中所含B原子个数为_____;其中原子坐标参数为:
,
,
,则c点原子的坐标参数为______。(坐标系如图)
(8)D与F形成离子个数比为1:1的化合物晶胞与
类似,D离子的配位数是________;设该晶胞的棱长为a pm,则该晶体的密度为________
(用相关字母表示,已知阿伏加德罗常数为NA)
高三化学综合题困难题查看答案及解析
-
【化学——选修3物质结构与性质】(15分)已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中
键和
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型
有____ (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
高三化学选择题困难题查看答案及解析
-
已知A、B、C、D、E、F为前4周期的6种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第4行、第11列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是 (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中σ键和π键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能由大到小的顺序排列为 (用元素符号表示)。
(4)C的单气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有 (填选项序号)。
①离子键 ②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为 ;B和E的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方最密堆积,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为acm,则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
高三化学填空题简单题查看答案及解析
-
已知A、B、C、D、E足周期表前四周期的元素,原子序数依次增大。A的基态原子2p能级有3个单电子;C的基态原子2p能级有1个单电子;F位于ds区,最外能层有单电子;D与E不同周期,但最外能层电子数相等。
(l)写出基态E原子的价电子排布式 。
(2)A、B、C三种元素第一电离能由大到小的顺序为_____________(用元素符号表示)。
(3)B、C两元素形成的化合物BC2的VSEPR模型名称为___________,已知BC2分子的极性比水分子的极性弱,其原因是________________。
(4)写出由A和B两种元素形成的与A3-互为等电子体的粒子的化学式__________(分子和离子各写一种)。
(5)B、D形成的一种离子化合物的晶胞结构如图l,已知该晶胞的边长为n cm,阿伏加德罗常数为NA,求晶胞的密度为ρ=__________g/cm3(用含a、NA的计算式表示)。
(6)由E原子形成的晶胞结构如图2,设晶胞参数为6,列式表示E原子在晶胞中的空间利用率 (不要求计算结果)。
高三化学填空题困难题查看答案及解析
-
已知A、B、C、D四种短周期元素的核电荷数依次增大。A原子s轨道电子数是p轨道电子数的两倍,C原子的L能层中有两对成对电子,C、D同主族。 E、F是第四周期元素,且E位于周期表中ds区, F原子核外有33种不同运动状态的电子。根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为 ,FC43-离子的空间构型为 ,与其互为等电子体的一种有机分子为 (填化学式)。
(2)B元素所在周期第一电离能最大的元素是 (填元素符号)。
(3)D所在周期元素最高价氧化物对应的水化物中,酸性最强的是 (填化学式);能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是 (填化学式)。
(4)已知EDC4溶液中滴入氨基乙酸钠(H2N—CH2—COONa)即可得到配合物A。其结构如图所示:
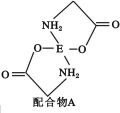
① 配合物A中碳原子的轨道杂化类型为 。
② 1 mol氨基乙酸钠(H2N—CH2—COONa)含有σ键的数目为 。
(5)化合物F2C3常用于标定未知浓度的酸性KMnO4溶液,反应生成F的最高价含氧酸,该反应的离子方程式是 。
高三化学填空题困难题查看答案及解析
-
已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A、B与C;D、E与F分别位于同一周期。A原子L层上有3个未成对电子,B的简单负二价离子与C原子核外电子排布相同、含有D元素的盐的焰色反应火焰为黄色,EF3是由活泼金属和活泼非金属组成的共价化合物,G有多种氧化物,其中一种氧化物有磁性,填写下列空白
(1)元素的第一电离能最大的是________, 属于过渡元素的是________(填写元素符号)
(2)写出B元素的基态原子价电子排布式__________________,F离子电子排布式_________________。
(3)AF3分子中A原子的杂化类型是________,AF3分子的几何构型为___________。
(4)已知E2B3的晶格比DF的晶格能大得多,试分析导致两者晶格能差异的主要原因是:________________________________________________________。
(5)构成G晶体的微粒是________,G的晶胞结构如下图甲所示,G的晶胞为________结构。若G原子的半径为1.27×10-10 m,G金属晶体中的晶胞长度,即下图乙中AB的长度为________m。

高三化学简答题中等难度题查看答案及解析