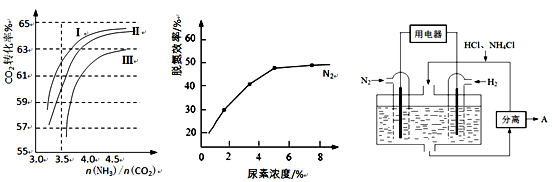
-
化学是与社会、环境等密切相关。下列有关说法中正确的是
A.发展“低碳经济”能够减少对化石能源的依赖
B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物
C.LED光源中的氮化镓(GaN)熔点为1700℃,属分子晶体
D.甲型H1N1流感病毒的蛋白质由C、H、O三种元素组成
难度: 简单查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1KNO3溶液:H+、Fe2+、SCN-、SO42-
B.c(H+)/ c(OH-)=10-10mol·L-1的溶液:K+、Ba2+、NO3-、Cl-
C.pH=0的溶液:Al3+、Cl-、SO42-、CO32-
D.c(ClO-) = 1.0 mol·L-1的溶液:Na+、I-、S2-、SO42-
难度: 困难查看答案及解析
-
下列有关说法正确的是
A.铅蓄电池放电过程中,正负极质量均增加
B.反应NH4Cl (s)=NH3(g)+HCl(g)在室温下不能自发进行,则该反应的ΔH>0
C.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
D.0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中c(OH-)、CH3COOH浓度均减少
难度: 中等查看答案及解析
-
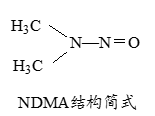
下列有关化学用语表示正确的是
A.对硝基甲苯的结构简式:
B.CH2F2的电子式:
C.HClO的结构式:H
-O-Cl
D.CO2的比例模型:
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A.SO2具有还原性,可用于漂白纸浆
B.NH4HCO3受热易分解,可用作氮肥
C.氢
氧化铝具有弱碱性,可用作净水剂
D.常温下铁能被浓硝酸钝化,可用铁质容器贮运浓硝酸
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是
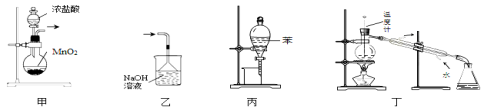
A.用装置甲制取氯气 B.用乙装置除去氯气中的HCl气体
C.用丙装置萃取溴水中的溴单质 D.用丁装置分离乙酸与乙醇
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法不正确的是
A. 元素W的最高价氧化物对应水化物的酸性比Q的强
B. 离子半径的大小顺序为:r(W2-)>r(Q-)>r(Y2-)>r(Z3+)
C. 元素X的氢化物与Q的氢化物化合的产物中既含共价键又含离子键
D. X、Z、W、Q四种元素的最高价氧化物对应水化物均能与强碱反应
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.氯气通入水中:Cl2 + H2O
2H+ + Cl-+ClO-
B.AgCl溶于氨水:AgCl+2NH3·H2O=[Ag(NH3)2]++Clˉ+2H2O
C.向NaAlO2溶液中通入过量的CO2:2AlO
+CO2+3H2O=2Al
(OH)3↓+CO32-
D.用稀硝酸除去试管内壁银:Ag+ 2H+ + NO3- = Ag+ + NO2↑ +H2O
难度: 中等查看答案及解析
-
在给定的条件下,下列选项所示的物质间转化均能实现的是
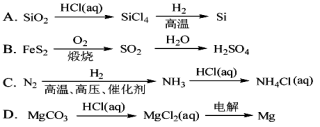
难度: 中等查看答案及解析
-
下列说法正确的是
A.化学反应的焓变与反应的途
径有关
B.室温下,稀释0.1mol·L-1CH3COOH溶液,溶液的导电能力减弱
C.常温常压下,22.4L Cl2中含有的分子数为6.02×1023个
D.等质量的铜按a、b两种途径完全转化为Cu(NO3)2,途径a、b消耗的硝酸一样多
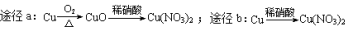
难度: 中等查看答案及解析
-
右图1为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,图2为电解AlCl3溶液的装置,电极材料均为石墨。用该装置进行实验,反应开始后观察到x电极附近出现白色沉淀。下列说法正确的是
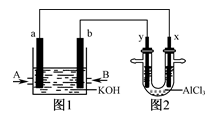
A.图1中电解质溶液的pH增大
B.图2中电解AlCl3溶液的总反应为2Cl-+2H2O
Cl2↑+H2↑+2OH-
C.A处通入的气体为CH4,电极反应式为CH4+10OH--8e-===CO32-+7H2O
D.电解池中Cl-向x极移动
难度: 困难查看答案及解析
-
根据下列
实验操作和现象所得出的结论错误的是
选项
实验操作
实验现象
结论
A
向FeBr2溶液中通入少量Cl2
溶液由浅绿
色变为黄色
氧化性:Cl2>Fe3+
B
向Na2SO3溶液中滴加盐酸
有气体产生
非金属性:Cl>S
C
向PH=3的HA和HB溶液中分别加水稀释至100倍
pH(HA)>pH(HB)
酸性:HA>HB
D
向重晶石中加入饱和碳酸钠溶液
重晶石逐渐溶解
溶度积:Ksp(BaCO3)<Ksp(BaSO4)
难度: 中等查看答案及解析
-
将5.10g镁铝合金加入120mL4.0mol·L-1的盐酸中,待合金完全溶解后,得到溶液X。下列说法一定正确的是
A.合金完全溶解后产生的H2的物质的量为0.24mol
B.合金中的镁与铝的物质的量之比小于1
C.若向溶液X中加入270mL2.0mol·L-1NaOH溶液,充分反应,所得沉淀为Mg(OH)2
D.若向溶液X中加入足量的氨水,充分反应,所得沉淀经过过滤、洗
涤后充分灼烧,则残留固体质量大于8.50g.
难度: 困难查看答案及解析
-
在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X(g)+Y(g)
2Z(g) ΔH<0。一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是
t/min
2
4
7
9
n(Y)/mol
0.12
0.11
0.10
0.10
A.反应前2 min的平均速率v(Z)=2.0×10-3 mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)=0.24 mol
D.该温度下此反应的平衡常数:K=1.44
难度: 困难查看答案及解析