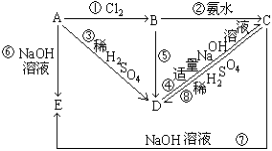
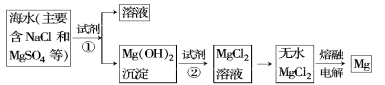
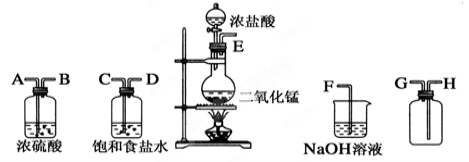
-
下列微粒中能影响水的电离平衡,且使水的电离平衡向左移动的是
A.SO42- B.Cl- C.Na+ D.
难度: 简单查看答案及解析
-
在实验室里,要想使AlCl3溶液中的Al3+全部沉淀出来,应最好选用下列试剂中的
A.石灰水 B.氢氧化钠溶液 C.硫酸 D.氨水
难度: 中等查看答案及解析
-
使用酸碱中和滴定的方法,用0.01 mol·L-1盐酸滴定锥形瓶中未知浓度的NaOH溶液,
下列操作能够使测定结果偏高的是
①用量筒量取浓盐酸配制0.01 mol·L-1稀盐酸时,量筒用蒸馏水洗净后未经干燥直接量取浓盐酸
②配制稀盐酸定容时,俯视容量瓶刻度线
③滴定结束时,读数后发现滴定管下端尖嘴处悬挂有一滴液滴
④滴定过程中用少量蒸馏水将锥形瓶内壁附着的盐酸冲下
A.①③ B.②④ C.②③④ D.①②③④
难度: 中等查看答案及解析
-
下列各反应的离子方程式中,错误的是
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O===Al(OH)3↓+3NH4+
B.金属钠投入水中: Na +H2O ===Na++OH-+H2↑
C.将铝片放入过量NaOH溶液中:2Al+2OH-+2H2O===2AlO2-+3H2↑
D.氧化铝溶于NaOH溶液:Al2O3+2OH-===2AlO2-+H2O
难度: 中等查看答案及解析
-
在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,下列说法正确的是
A.AgCl沉淀溶解平衡正向移动 B.AgCl溶解度增大
C.溶液中c(Ag+)增大 D.溶液中c(Cl-)增大
难度: 中等查看答案及解析
-
某同学在实验报告中有以下的实验数据:
①用托盘天平称取11.7g食盐
②用量筒量取5.26 mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用标准NaOH溶液滴定未知浓度的盐酸,用去23.10 mL NaOH溶液。
其中数据合理的是
A.①②③ B.①③④ C.①②③④ D.①④
难度: 简单查看答案及解析
-
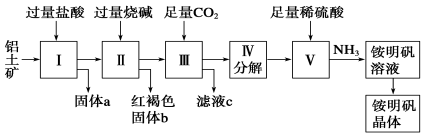
从铝土矿制备铝所涉及的下列有关反应中,属于氧化还原反应的是
A.铝土矿溶于NaOH溶液中 B.偏铝酸钠溶液的酸化
C.灼烧氢氧化铝固体 D.电解熔融的氧化铝
难度: 中等查看答案及解析
-
将2.3g金属钠放入100g水中,完全反应后溶液的质量分数为
A.
100% B.
100%
C.
100% D.
100%
难度: 困难查看答案及解析
-
把0.02mol/LCH3COOH溶液和0.01mol/LNaOH溶液等体积混合,则混合溶液中微粒浓度关系正确的是
A.c(CH3COO-)>c(Na+)
B.c(CH3COOH)>c(CH3COO-)
C.2c(H+)= c(CH3COO-) – c(CH3COOH)
D.c(CH3COOH)+ c(CH3COO-)=0.02mol/L
难度: 中等查看答案及解析
-
有下列四组物质,如果把某组物质中的后者逐滴加入到前者至过量,将出现“产生白色沉淀,后白色沉淀溶解”的现象,这组物质是
A.稀硫酸、氯化钡溶液 B.硫酸亚铁溶液、氢氧化钠溶液
C.氯化钠溶液、硝酸银溶液 D.氯化铝溶液、氢氧化钠溶液
难度: 中等查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是
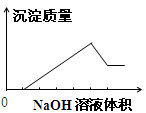
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 困难查看答案及解析
-
滴加新制氯水后,下列各组离子可能大量存在的是
A.Fe3+、Al3+、Cl-、NO3- B.K+、Na+、I-、SO42-
C.Ag+、Ca2+、NH4+、NO3- D.Na+、Ba2+、CO32-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.金属氧化物一定是碱性氧化物
B.碱性氧化物一定是金属氧化物
C.非金属氧化物一定是酸性氧化物
D.酸性氧化物一定是非金属氧化物
难度: 中等查看答案及解析
-
已知某温度下某些弱酸的电离常数如下表:
弱酸
HCN
HF
CH3COOH
HNO2
Ka
6.2×10-10
6.8×10-4
1.8×10-5
6.4×10-6
物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
A.HCN B.HF C.CH3COOH D.HNO2
难度: 中等查看答案及解析
-
下列溶液一定呈中性的是
A.pH=7的溶液
B.c(H)+=10-7 mol·L-1的溶液
C.c(H+)/c(OH-)=10-14的溶液
D.氨水和氯化铵的混合液中c(NH4+)=c(Cl-)
难度: 中等查看答案及解析
-
在盛有溴水的三支试管中分别加入少量苯、四氯化碳和酒精,振荡后静置,出现下列现象,正确的结论是
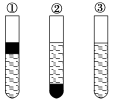
A.①加CCl4②加苯 ③加酒精 B.①加酒精 ②加CCl4 ③加苯
C.①加苯 ②加CCl4 ③加酒精 D.①加苯 ②加酒精 ③加CCl4
难度: 中等查看答案及解析
-
在新制的氯水中存在下列平衡:Cl2+H2O
H++Cl-+HClO,若向氯水中加入少量Na2CO3粉末,溶液中发生的变化是
A.pH增大,HClO浓度减小 B.pH减小,HClO浓度增大
C.pH增大,HClO浓度增大 D.pH减小,HClO浓度减小
难度: 中等查看答案及解析
-
下列各组中的两物质作用时,反应条件或反应物用量的改变,对生成物没有影响的
A.Na2O2与CO2 B.Na与O2 C.NaOH与CO2 D.碳与O2
难度: 中等查看答案及解析
-
在下列五种物质的组合中,既能跟氢氧化钠溶液反应,又能跟盐酸反应的化合物是
①Al ②Al(OH)3 ③Al2O3 ④Na2CO3 ⑤NaHCO3
A.①②③ B.①③⑤ C.①②③⑤ D.②④⑤
难度: 中等查看答案及解析
-
质量相等的两份铝,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积比为
A.1:1 B.1:3 C.2:3 D.3:2
难度: 中等查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是
A.AgCl>AgI>Ag2CrO4 B.AgCl>Ag2CrO4>AgI
C.Ag2CrO4>AgCl>AgI D.Ag2CrO4>AgI>AgCl
难度: 中等查看答案及解析
-
将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol/L的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
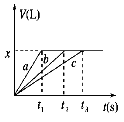
A.x=2.24
B.钠的物质的量为0.2 mol
C.反应时,Na、Mg、Al均过量
D.曲线b为Mg与盐酸反应的图像
难度: 困难查看答案及解析
-
有两种金属的合金10.5克,与足量稀硫酸反应后,产生的气体在标况下占体积11.2 L,则组成该合金的元素可能是
A.Mg和Al B.Fe和Zn C.Mg和Cu D.Na和Zn
难度: 困难查看答案及解析