-
下列排列顺序完全正确的组合是
①溶解性:Na2CO3>NaHCO3>AgCl>AgI
②氧化性:MnO2>Cl2>Fe3+>Cu2+
③常温下,α1、α2、α3分别表示pH=2的盐酸、pH=12的氨水、pH=12的碳酸钠溶液中水的电离程度,则α1=α2>α3
④同温下,1L0.5mol•L-1NH4Cl溶液中NH4+数与2L0.25mol•L-1NH4Cl溶液中NH4+数分别为a、b,则a>b( )
A.①②③
B.②③④
C.①③④
D.①②④难度: 中等查看答案及解析
-
有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、MnO4-离子中的几种.为确定其成分,进行如下实验:①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀且白色沉淀逐渐增多后又部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰.下列推断正确的是( )
A.肯定有Na+、Al3+、Mg2+、SO42-
B.肯定有Na+、Mg2+、Al3+、Cl-
C.肯定没有K+、HCO3-、MnO4-
D.肯定没有K+、NH4+、Cl-难度: 中等查看答案及解析
-
下列溶液中,各关系式正确的是( )
A.等浓度、等体积的NaOH和二元弱酸H2A混和溶液中:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.1 L 0.1 mol•L-1CuSO4•(NH4)2SO4•6H2O的溶液中:c(NH4+)>c(SO42-)>c(Cu2+)>c(H+)>c(OH-)
C.已知两种弱酸HA、HB的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol•L-1的HA、HB、NaA、NaB溶液中:pH(NaA)>pH(NaB)>pH(HA)>pH(HB)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-)难度: 中等查看答案及解析
-
化学实验中常进行酸化或碱化处理,下列表述合理的是( )
A.配制硝酸银溶液时,用盐酸酸化
B.配制酸性KMnO4溶液时,用盐酸酸化
C.将淀粉置于稀硫酸中加热,加NaOH溶液至强碱性,再滴入碘水,以检验淀粉是否完全水解
D.卤代烃在碱性溶液中水解后用硝酸酸化,再滴加AgNO3溶液,以检验卤代烃中是否含氯难度: 中等查看答案及解析
-
化学与科技、生活、环境密切相关,下列说法正确的是( )
A.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
B.棉、麻、丝、毛及合成纤维完全燃烧都是只生成CO2和H2O
C.为防止电池中的重金属污染土壤和水体,应将废电池深埋
D.自来水厂在处理水时常加入硫酸亚铁和氯气,能同时达到消毒杀菌和除去水中悬浮杂质的作用难度: 中等查看答案及解析
-
下列表述与化学用语对应且正确的是( )
A.CO2的比例模型: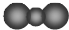
B.氢化铵(NH4H)电子式:
C.的名称:2,3-二甲基-4-乙基己烷
D.乙酸乙酯的水【解析】
CH3COOCH2CH3+H218OCH3COOH+CH3CH218OH
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.17g甲基(-14CH3)所含中子数为9NA
B.标准状况下,密度为ρg•L-1的某气体纯净物一个分子的质量为g
C.25℃时,1 L pH=13的NaOH溶液中含有NA个氢氧根离子
D.常温下,0.2molCl2溶于等体积水中,转移电子数为0.2 NA难度: 中等查看答案及解析
-
下列实验对应的结论不正确的是( )
A.
能组成Zn、Cu原电池
B.
能证明非金属性Cl>C>Si
C.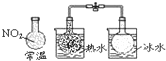
说明反应2NO2⇌N2O4,△H<0
D.
白色沉淀为BaSO4难度: 中等查看答案及解析
-
科学家发现了如下反应:O2+PtF6=O2 (PtF6),O2(PtF6)为离子化合物,其中Pt为+5价.下列说法正确的是( )
A.O2 (PtF6) 中不存在共价键
B.O2 (PtF6)中氧元素的化合价是+l价
C.在此反应中每生成1mol O2 (Pt F6),转移lmol电子
D.在此反应中,O2是氧化剂,PtF6是还原剂难度: 中等查看答案及解析
-
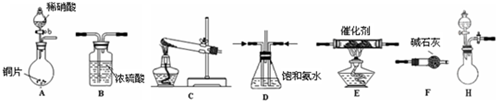
工业上先后用下列方法制备金属钠:
①用石墨作电极电解熔融氢氧化钠制钠;
②铁与熔融氢氧化钠作用制钠:3Fe+4NaOHFe3O4+2H2↑十4Na↑;
③电解熔融氯化钠.
下列有关说法正确的是( )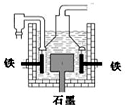
A.电解熔融氢氧化钠制钠的反应为:4NaOH(熔)4Na+2O2↑+2H2↑
B.在电解熔融氯化钠的电解槽(如图)中,石墨为阳极,铁为阴极
C.电解熔融氯化钠时,Na+向阳极移动
D.方法①与②制得等量的钠,两反应中转移的电子总数相等难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.在硫酸氢钾溶液中加入Ba(OH)2溶液使SO42-恰好完全沉淀:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.向NaHS溶液中滴加少量CuCl2溶液:S2-+Cu2+=CuS↓
C.在银氨溶液中滴加过量氢溴酸:[Ag(NH3)2]++OH-+3H++Br-=AgBr↓+2NH4++H2O
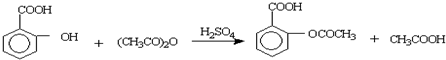
D.水杨酸()与足量的Na2CO3溶液混合:
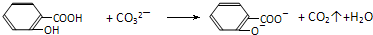
难度: 中等查看答案及解析
-
人们能够在昏暗的光线下看见物体,是因为视网膜中的“视黄醛”吸收光线后,其分子结构由顺式转变为反式,并从所在蛋白质上脱离,这个过程产生的信号传递给大脑.下列有关“视黄醛”的说法正确的是( )

A.“视黄醛”属于烯烃
B.“视黄醛”的分子式为C20H15O
C.“视黄醛”能与银氨溶液发生银镜反应
D.在金属镍催化并加热下,1mol“视黄醛”最多能与6 molH2发生加成反应难度: 中等查看答案及解析
-
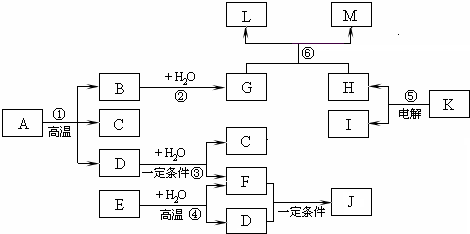
工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下:
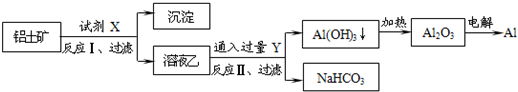
对上述流程中的判断正确的是( )
A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应 II 中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
C.结合质子 ( H+) 的能力由弱到强的顺序是OH->AlO2->CO32-
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al难度: 中等查看答案及解析
-
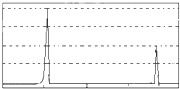
已知:2M(g)⇌N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )

A.a、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25min时,曲线发生变化的原因是加入了0.4molN
C.若40min后出现如图所示变化,则可能是加入了某种催化剂
D.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度难度: 中等查看答案及解析