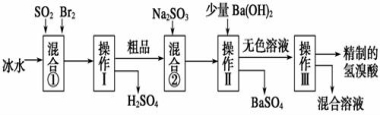
-
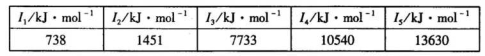
将0.2molMnO2和50mLl2mol·L-1盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为( )(不考虑盐酸的挥发)
A.等于0.3 mol
B.小于0.3mol
C.大于0.3mol、小于0.6mol
D.以上结论都不正确
难度: 中等查看答案及解析
-
下列现象或变化过程与胶体的性质无关的是 ( )
A.清晨森林中的道道光柱 B.夕阳下的晚霞
C.海水的淡化 D.明矾净水
难度: 中等查看答案及解析
-
下列有关实验的叙述正确的是( )
A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
B.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D.读取滴定管内液体的体积,俯视读数导致读数偏小
难度: 中等查看答案及解析
-
下列实验过程中,始终无明显现象的是( )
A.CO2通入饱和Na2CO3溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中
难度: 中等查看答案及解析
-
市场上销售的“84”消毒液,其商品标识上有如下叙述:①本品为无色液体,呈碱性②使用时加水稀释③可对餐具、衣物进行消毒,可漂白浅色衣物。其有效成分可能是( )
A.Cl2 B.SO2 C.NaClO D.KMn04
难度: 中等查看答案及解析
-
下列各说法正确的是
A.弱电解质的导电能力一定比强电解质的导电能力弱
B.pH=4的醋酸与pH=10的NaOH溶液等体积混合后溶液显碱性
C.豆浆中加入硫酸钙会使蛋白质聚沉.
D.同浓度①NaHCO3、②Na2CO3、③CH3COONa四种溶液,pH大小顺序是②>③>①
难度: 中等查看答案及解析
-
把500 mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1 ( b – 2a ) mol/L B.10 ( 2a – b ) mol/L
C.10 ( b – a ) mol/L D.10 ( b – 2a ) mol/L
难度: 中等查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
难度: 中等查看答案及解析
-
某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完全后,该比值变为3:2:1,则反应的Cl2和原溶液中I-的物质的量之比是( )
A.1:2 B.1:3 C.1:4 D.1:6
难度: 中等查看答案及解析
-
向FeCl3和BaCl2的酸性混合溶液中,通入SO2气体,有白色沉淀生成。此沉淀是( )
A.BaSO4 B.FeS C.BaSO3 D.S
难度: 简单查看答案及解析
-
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是( )
⑴Cl2+2KI=2KCl+I2; ⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2,⑷H2S+I2=S+2HI;
A.S>I2>Fe3+>Cl2 B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2 D.Cl2>I2>Fe3+>S
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式是 ( )
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓
C.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
D.向碳酸氢钠溶液中滴加少量稀硝酸:CO32 - + 2H + = CO2 + H2O
难度: 中等查看答案及解析
-
根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为 ( )
A. 1︰1 B. 2︰1 C. 1︰2 D. 2︰3
难度: 中等查看答案及解析
-
下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白色烟雾
B.氧化铁溶于水生成红褐色沉淀
C.铜在氯气中燃烧,产生棕黄色烟
D.钠在空气中燃烧,发出黄色的火焰,生成白色固体
难度: 中等查看答案及解析
-
下列结论可靠的是
A.试液
白色沉淀
沉淀不溶解 结论:试液中一定含SO42-
B.气体
无色气体
白色沉淀 结论:原气体一定是CO
C.溶液
冒白雾
白烟
结论:原溶液一定是浓盐酸
D.有色溶液
变红色 结论:原溶液中一定含Fe3+
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是 ( )
A.向氢氧化钠溶液中通入Cl2:Cl2+ 2OH-= Cl- +ClO- +H2O
B.向次氯酸钙溶液通入SO2:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
C.氢氧化钡溶液与硫酸溶液反应:Ba2++SO42-=BaSO4↓
D.高锰酸钾溶液与浓盐酸混合:2MnO4- +2Cl- +16H+=2Mn2++Cl2↑+8H2O
难度: 中等查看答案及解析
-
下列各组试剂中,只用试管和胶头滴管,不用其他试剂就可以鉴别的是( )
A.NaHSO4溶液和Na2CO3溶液 B.稀盐酸和AgNO3溶液
C.AlCl3溶液和NH3·H2O溶液 D.Ba(OH)2溶液和NaHCO3溶液
难度: 中等查看答案及解析
-
在强酸性溶液中能大量共存的无色透明离子组是 ( )
A.K+、Na+、NO3-、MnO4- B.Mg2+、Na+、Cl-、SO42-
C.K+、Na+、Br-、Cu2+ D.Na+、Ba2+、OH-、SO42-
难度: 中等查看答案及解析
-
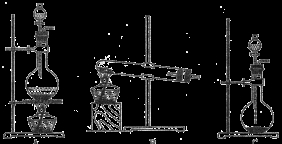
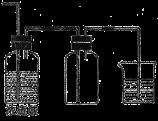
下列有关实验原理或操作正确的是 ( )
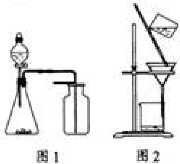
A.选择合适的试剂,用图1所示装置可分别制取收集少量CO2、NO、O2
B.配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用干燥的pH试纸可测得新制氯水的pH=2
难度: 中等查看答案及解析
-
将0.5 mol Na和0.5 mol Mg分别投入到过量的m1 g水和m2 g盐酸中,分别得到溶液a和b,若m1 = m2,则a和b的质量关系是 ( )
A.a>b B.a<b C.a=b D.无法确定
难度: 中等查看答案及解析
-
对于反应KClO3+ HCl = KC1 + Cl2 ↑+ H2O(未配平)若有0.1 mol KClO3 参加反应,下列说法正确的是 ( )
A.转移0.5 mol电子 B.生成0.1 mol Cl2
C.被氧化的HC1为0.6 mol D.Cl2是只是氧化产物不是还原产物
难度: 中等查看答案及解析
-
在8NH3 + 3Cl2 = N2+ 6NH4Cl反应中,被氧化的原子与被还原的原子的物质的量之比为
A.8:3 B.1:3 C.3:8 D.3:1
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.1mol铁与足量盐酸完全反应转移的电子数目为3NA
B.28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C.100mL 1mol/L FeCl3溶液中含有Fe3+为0.1NA
D.32g氧气和32g臭氧(O3)所含有的氧原子数之比为2:3
难度: 中等查看答案及解析
-
同温同压下,相同体积的CO和CO2,下列比较中正确的是( )
①所含的分子数目之比为1︰1 ②所含的O原子数目之比为1︰2
③所含的原子总数目之比为2︰3 ④两者的密度之比为:7:11
⑤所含的电子数目之比为7︰11
A.①和④ B.②和③ C.④和⑤ D.①②③④⑤
难度: 中等查看答案及解析