-
下列试剂瓶上的标识与物质性质对应正确的是
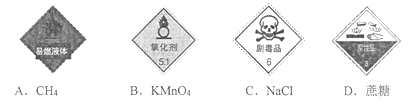
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列物质中属于电解质的是
A. 氢氧化钠溶液 B. 铜 C. 氯化钠 D. 三氧化硫
难度: 中等查看答案及解析
-
当光束通过下列分散系时,可观察到丁达尔效应的是
A. 乙醇溶液 B. 氯化钠溶液
C. 硫酸铜溶液 D. 氢氧化铁胶体
难度: 中等查看答案及解析
-
NaCl、
、NaClO、
、
是按某一规律排列的。下列物质系列中也完全按照此规律排列的是
A.
、C、
、CO、
B.
、S、
、
、
C.
、NO、
、
、
D.
、
、
、
、
难度: 简单查看答案及解析
-
下列反应中涉及氧化还原反应的是
A. 铁锅生锈
B. 用过量
溶液除去粗盐中的
离子
C. 食品干燥剂(主要成分为生石灰)发挥作用
D. 用鸡蛋壳膜(半透膜)和蒸馏水除去淀粉溶液中的食盐
难度: 简单查看答案及解析
-
下列指定微粒的物质的量是1 mol的是
A. 2g
B. 常温常压下22.4L
C. 18g水中的原子总数
D. 100mL 1mol/L NaCl溶液中的
难度: 中等查看答案及解析
-
从氮元素的化合价判断,下列物质只能具有还原性的是
A.
B. NO C.
D.
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 物质的量就是物质的质量
B. 阿伏加德罗常数就是6.02×10
C. 物质的量的单位是摩尔
D. O
的摩尔质量是32g
难度: 简单查看答案及解析
-
下列叙述正确的是
A. 1 mol
中,电子的物质的量为11 mol
B. 将4g NaOH溶解于1 L水中所得溶液物质的量浓度为1 mol·L
C. 等质量的臭氧(O
)与氧气所含的原子数相等
D. 标准状况下1mol任何物质体积均约为22.4L
难度: 中等查看答案及解析
-
判断下列概念的依据正确的是
A. 纯净物与混合物:是否仅含有一种元素
B. 溶液与胶体:本质不同的原因是能否发生丁达尔现象
C. 强电解质与弱电解质:溶液的导电能力大小
D. 氧化还原反应的本质:有电子转移
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是
A. 在无色溶液中:
、
、
、
B. 在含大量
的溶液中:
、
、
、
C. 在强酸性溶液中:
、
、
、
D. 在强碱性溶液中:
、
、
、
难度: 中等查看答案及解析
-
甲、乙、丙、丁分别是氢氧化钙溶液、硝酸钾溶液、碳酸钠溶液、盐酸中的一种。已知甲和丙可以反应,甲和丁也可以反应,则下列说法正确的是
A. 甲一定是氢氧化钙溶液 B. 乙一定是硝酸钾溶液
C. 丙不可能是碳酸钠溶液 D. 丁只能是盐酸
难度: 困难查看答案及解析
-
废水脱氮工艺中有一种方法是在废水中加入过量NaClO使NH4+完全转化为N2,该反应可表示为2NH4++3ClO-=N2↑+3Cl-+2H++3H2O。下列说法中,不正确的是
A. 反应中氮元素被氧化,氯元素被还原
B. 还原性NH4+< Cl-
C. 反应中每生成1 mol N2,转移6 mol电子
D. 经此法处理过的废水不可以直接排放
难度: 中等查看答案及解析
-
用
表示阿伏加德罗常数的数值,下列说法中正确的是
A. 在常温常压下,11.2L氯气所含的原子数为
B. 2.3g金属钠被氧化成Na2O2,转移电子数为0.1
C. 5.6g铁与足量稀盐酸反应转移的电子数为0.3
D. 2L 0.1 mol/LNa2SO4溶液中含有的Na+的数为0.2
难度: 困难查看答案及解析
-
下列离子方程式中,正确的是
A. 石灰石与盐酸反应:
B. 铜和硝酸银溶液反应:
C. 向NaHSO4溶液中滴加
溶液至
离子恰好沉淀完全:
D.
溶液与过量HCl溶液混合:
难度: 困难查看答案及解析
-
矿泉水在开采过程中会含有少量溴化物(
),在后续的生产过程中经臭氧(
)处理逐渐转化成溴酸盐(
)。下列有关该转化过程的认识正确的是
A. 该过程中溴化物(
)得到电子
B. 该过程中臭氧(
)是氧化剂,溴酸盐(
)是还原剂
C. 该过程中溴元素被氧化
D. 该过程中
发生氧化反应
难度: 中等查看答案及解析
-
下列反应中,盐酸既表现出酸性,又表现出还原性的是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
与30 mL 0.1 mol/L的
溶液中
的物质的量浓度相等的是
A. 15 mL 0.2mol/L的
溶液
B. 30 mL 0.1mol/L的
溶液
C. 10 mL 0.2mol/L的
溶液
D. 30 mL 0.3mol/L的NaCl溶液
难度: 中等查看答案及解析
-
在100mL 0.1 mol/L的
溶液中加入100mL溶有2.08 g
的溶液,再加入100mL溶有0.01mol
·
的溶液,充分反应(
微溶,AgCl、
比
更易沉淀)。下列说法中正确的是
A. 最终得到白色沉淀和无色溶液
B. 最终得到的白色沉淀是等物质的量的两种化合物的混合物
C. 在最终得到的溶液中,
D. 在最终得到的溶液中,
难度: 困难查看答案及解析
-
已知
在酸性溶液中易被还原成
,且
、
、
、
的氧化性依次减弱。下列叙述中,正确的是
A.
通入
溶液中,可存在反应3
+6
====2
+4
B. 每1 mol
在酸性溶液中被氧化生成
时转移2 mol
C.
溶液能将KI溶液中的I-氧化
D. I2具有较强的氧化性,可以将
氧化成
难度: 困难查看答案及解析

