-
分别将下列物质:①FeCl3 ②CaO ③NaCl ④Ca(HCO3)2 ⑤Na2SO3 ⑥K2SO4投入水中,在蒸发皿中对其溶液加热蒸干,能得到原物质的是
A.②③ B.③⑥ C.①④ D.⑤⑥
难度: 中等查看答案及解析
-
下列各组离子在溶液中能够大量共存的是
A、NH4+、NO3-、Na+、SO42- B、H+、Fe2+、Na+、NO3-
C、 Ba2+、K+、Al3+、HCO3- D、NH4+、Li+、OH-、SO42-
难度: 中等查看答案及解析
-
为了配制NH4+的浓度与Cl﹣的浓度比为1:1的溶液,可在NH4Cl溶液中加入( )
①适量的HCl; ②适量的NaCl; ③适量的氨水; ④适量的NaOH.
A. ①② B. ③ C. ③④ D. ④
难度: 简单查看答案及解析
-
一元强酸X和一元弱酸Y,它们的pH都等于2,各取1L与足量的镁完全反应产生氢气。下列叙述中,正确的是( )
①X能产生较多的氢气 ②Y能产生较多的氢气
③两者产生氢气的量相同 ④开始反应速率X较快
⑤开始反应速率Y较快 ⑥开始反应速率相同
A. ①④ B. ②③ C. ③⑥ D. ②⑥
难度: 中等查看答案及解析
-
用一价离子组成四种盐,AC、BD、AD、BC的1mol·L-1 溶液,在室温下前两种溶液的pH=7,第三种溶液的pH >7,最后一种溶液的pH< 7,则。
A
B
C
D
碱性
AOH>BOH
AOH<BOH
AOH>BOH
AOH<BOH
酸性
HC>HD
HC>HD
HC<HD
HC<HD
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
相同温度下等物质的量浓度的下列溶液中,pH值最小的是( )
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
难度: 中等查看答案及解析
-
常温下,AgCl、AgBr、AgI的溶度积常数(Ksp)依次为1.8×10﹣10mol2•L﹣2、5.0×10﹣13mol2•L﹣2、8.3×10﹣17mol2•L﹣2。下列有关说法错误的是( )
A. 常温下在水中溶解能力AgCl>AgBr>AgI
B. 在AgCl饱和溶液中加入足量浓NaBr溶液有AgBr沉淀生成
C. 在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCl沉淀生成
D. 在AgI饱和溶液中加入NaI固体有AgI沉淀析出
难度: 中等查看答案及解析
-
下列有关电解质溶液中微粒的物质的量浓度关系正确的是
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3-)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO-)>c(CH3COOH)>c(H+)=c(OH-)
难度: 困难查看答案及解析
-
实验室现有3种酸碱指示剂,其pH变色范围如下
甲基橙:3.1~4.4 石蕊:5.0~8.0 酚酞:8.2~10.0
用0.100 0 mol·L-1 NaOH溶液滴定未知浓度的CH3COOH溶液,反应恰好完全时,下列叙述中正确的是( )
A.溶液呈中性,可选用甲基橙或酚酞作指示剂
B.溶液呈中性,只能选用石蕊作指示剂
C.溶液呈碱性,可选用甲基橙或酚酞作指示剂
D.溶液呈碱性,只能选用酚酞作指示剂
难度: 简单查看答案及解析
-
室温下,将0.1mol·L-1盐酸滴入20mL 0.1 mol·L-1氨水中,溶液pH随加入盐酸体积的变化曲线如图所示。下列有关说法不正确的是( )
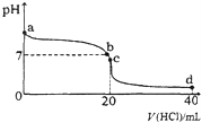
A. a点的pH>7,但Kw仍为1.0×10−14
B. b点所示溶液中c(Cl−)=c(NH4+)
C. C点溶液pH<7,其原因是NH4++H2O
NH3·H2O+H+
D. d点所示溶液中离子浓度由大到小的排序是:c(Cl−)>c(NH4+)>c(H+)>c(OH−)
难度: 中等查看答案及解析
-
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,( )
A.通入二氧化碳气体 B.加入氢氧化钠固体
C.通入氯化氢气体 D.加入饱和石灰水溶液
难度: 中等查看答案及解析
-
关于10mL 0.1mol·L−1的NH3·H2O溶液,下列说法正确的是( )
A. 25℃时,若溶液的pH=11,则Kb(NH3·H2O)=1×10−6
B. 向溶液中加入少量CH3COONa固体,溶液中c(NH3·H2O)/c(NH4+)的值变小
C. 向溶液中加入10mL0.1 mol·L−1盐酸,所得溶液中离子浓度大小顺序为:c(NH4+)>(Cl−)>c(H+)>c(OH−)
D. 向溶液中加入5 mL 0.1 mol·L−1盐酸,所得溶液中离子的浓度一定符合:c(NH4+)+c(H+)=c(Cl−)+c(OH−)
难度: 中等查看答案及解析
-
下列各项数据中,其比值为1:1的是( )
A. pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO42-)之比
B. 相同温度下,1L 0.2mol·L的CH3COOH溶液与2L 0.1mol·L的CH3COOH溶液中所含的n(H+)之比
C. NaHS溶液中c(Na+)与c(HS−)之比
D. pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH−)之比
难度: 中等查看答案及解析
-
往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如右图所示。则原溶液中c(I-)/c(Cl-)的比值为( )
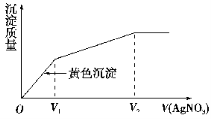
A.(V2-V1)/V1 B.V1/V2
C.V1/(V2-V1) D.V2/V1
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O═3I2+6OH-
B. 将过量SO2通入冷氨水中:SO2+NH3·H2O═HSO3-+NH4+
C. 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-═NH3↑+H2O
D. Ba(OH)2 溶液中逐滴加入一定物质的量浓度NaHSO4溶液,当溶液中的OH-恰好反应一半时: Ba2++2OH-+2H++SO42-===BaSO4↓+2H2O
难度: 中等查看答案及解析
-
化学与数学有密切的联系,将某些化学知识用数轴表示,可以受到直观形象、简明易记的良好效果。下列用数轴表示的化学知识中错误的是( )
A. 分散系的分类
B. 铁与稀硝酸反应后溶液中铁元素的存在形式
C. CO2通入澄清石灰水中反应的产物
D. AlCl3溶液中滴加NaOH溶液后Al元素的存在形式
难度: 困难查看答案及解析
-
已知Ag2SO4的Ksp为2.0×10-5 mol3·L-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+ 和SO42-浓度随时间变化关系如右图[饱和Ag2SO4溶液中c(Ag+)=0.034 mol•L-1]。若t1时刻在上述体系中加入100 mL 0.020 mol•L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+ 和SO42-浓度随时间变化关系的是
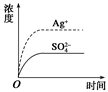
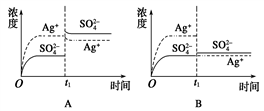
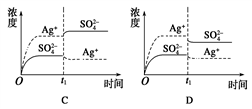
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有一澄清透明的溶液,只可能含有大量的Fe3+、Fe2+、H+、[Al(OH)4]-、Al3+、CO32-、NO3-七种离子中的几种,向该溶液中逐滴加入一定量1mol/L NaOH溶液的过程中,开始没有沉淀,而后才有沉淀.则下列判断正确的是( )
A. 溶液中可能含有[Al(OH)4]- B. 溶液中可能含有NO3-
C. 溶液中一定不含Fe2+和Fe3+ D. 溶液中可能含有Fe3+,但一定不含Fe2+
难度: 中等查看答案及解析