-
下列反应既属于氧化还原反应,又属于吸热反应的是( )
A.Na2O2与H2O反应 B.灼热的木炭与水蒸气反应
C.铝热反应 D.CH4与O2反应
难度: 简单查看答案及解析
-
下列电池工作时,负极上有H2参与反应的是( )

难度: 简单查看答案及解析
-
在A(g)+B(g)=C(g)+2D(g)反应中,下列表示的反应速率最快的是( )
A.v(A)═0.1mol·L-1·min B.v(B)═0.2 mol·L-1·min
C.v(C)═0.3 mol·L-1·min D.v(D)═0.4mol·L-1·min
难度: 简单查看答案及解析
-
下列物质在水溶液中的电离方程式书写不正确的是( )
A.NaHCO3=Na++H++CO32- B.Cu(OH)2
Cu2++2OH-
C.CH3COONH4=CH3COO-+NH4+ D.H2S
H++HS-
难度: 简单查看答案及解析
-
常温下,物质的量浓度均为0.1mol·L-1的下列四种溶液,其中pH最小的是( )
A.NaCl B.Ba(OH)2 C.NH4Al(SO4)2 D.Na3PO4
难度: 简单查看答案及解析
-
已知T℃时,CaCO3(s)=CaO(s)+CO2(g) △H=+177.70kJ·mol-1,则每生成28gCaO(s)时,吸收的热量为( )
A. 44.43KJ B.88.85KJ C. 133.28KJ D. 177.70kJ
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.原电池的正极材料必须是金属
B.原电池的负极发生还原反应
C.实验室欲快速制取氢气,可利用粗锌与稀硫酸反应
D.原电池可以把物质内部的能量全部转化为电能
难度: 简单查看答案及解析
-
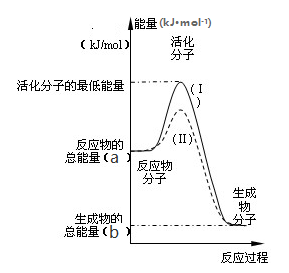
在隔绝空气的条件下发生反应:CH4(g)=C(g)+2H2(g) △H>0,下列说法正确的是( )
A.低温下是非自发反应,高温下是自发反应
B.任何温度下都是自发反应
C.低温下是自发反应,高温下是非自发反应
D.任何温度下都是非自发反应
难度: 中等查看答案及解析
-
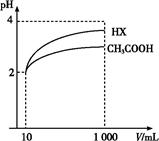
现有常温下pH=2的醋酸溶液,下列有关叙述正确的是( )
A.c(H+)=c(CH3COO-)
B.醋酸的物质的量浓度为0.01mol·L-1
C.与pH=12的NaOH溶液等体积混合后,溶液呈碱性
D.加入醋酸钠固体可抑制醋酸的电离,但电离常数Ka不变
难度: 简单查看答案及解析
-
某新型蓄电池放电、充电时的反应为Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2。下列推断中不正确的是( )
A.充电时,Ni(OH)2为阳极
B.放电时,Fe为正极,Ni2O3为负极
C.该新型蓄电池的电解质溶液呈碱性
D.充电时,阴极反应式为Fe(OH)2+2e-=Fe+2OH-
难度: 中等查看答案及解析
-
下列有关0.10mol·L-1的NH4Cl溶液的叙述正确的是( )
A.c(H+)<c(OH-) B.c(NH4+)>c(Cl-)
C.c(NH4+)+c(H+)=c(Cl-)+c(OH-) D.c(NH4+)+c(Cl-)=0.10mol·L-1
难度: 简单查看答案及解析
-
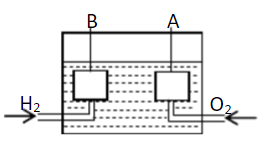
工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列说法不正确的是( )
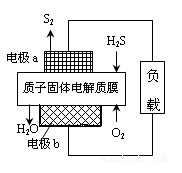
A.电极a为电池的负极
B.电极b上发生的电极反应为O2+4H++4e-=2H2O
C.若电路中通过2mol电子,则电池内部释放632kJ热能
D.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
难度: 困难查看答案及解析
-
Li-SOCl2电池是迄今具有最高能量比的电池。该电池中锂为负极,碳棒为正极,无水四氯铝酸锂(LiAlCl4)的SOCl2溶液为电解液。电池总反应为电池的总反应可表示为:4Li+2SOCl2= 4LiCl +SO2 +S。下列说法不正确的是
A.负极的电极反应式为 Li-e-=Li+
B.正极的电极反应式为2SOCl2+4e-=SO2+S+4Cl-
C.若电解液中含有水,则该电池的效率将大大降低
D.若负极有14gLi参加反应,则理论上流过电路中的电子书约为1.204×1023
难度: 困难查看答案及解析
-
下列说法错误的是( )
A.NaClO溶液中:c(Na+)=c(ClO-)+c(OH-)+c(HClO)
B.常温下,pH=a的NH4Cl溶液中由水电离产生的c(OH-)=10-amol·L-1
C.向0.1 mol·L-1的Na2SO3溶液中加入少量NaOH固体,c(Na+)、c(SO32-)均增大
D.Na2S稀溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-)
难度: 中等查看答案及解析
-
一定条件下,在密闭容器中充入一定量的X和Y发生可逆反应:X(g)+2Y(g)
3Z(g),达到平衡,测得Y的转化率为 37.5%,X的转化率为25%,则反应开始时,充入容器中的X和Y的物质的量之比为( )
A.1∶3 B.3∶1 C.4∶3 D.3∶4
难度: 中等查看答案及解析
-
常温下,向10mL 0.1mol·L-1HR溶液中逐滴滴入0.1mol·L-1的氨水,所得溶液pH及导电能力与加入氨水体积的关系如图。下列说法不正确的是( )
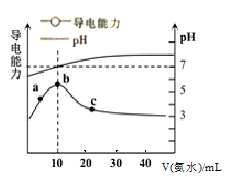
A.常温下,电离平衡常数Ka(HR)≈Kb(NH3·H2O)
B.b点溶液pH=7,此时HR溶液与氨水恰好完全反应
C.c点溶液中存在c(NH4+)>c(R-)>c(OH-)>c(H+)
D.a、b、c三点中,c点NH3·H2O的电离程度最大
难度: 困难查看答案及解析