-
化学在生活中有着广泛的应用,下列对应关系错误的是
化学性质
实际应用
A
Al2(SO4)3和小苏打反应
泡沫灭火器灭火
B
铁比铜金属性强
FeCl3腐蚀Cu刻制印刷电路板
C
次氯酸盐具有氧化性
漂白粉漂白织物
D
HF与SiO2反应
氢氟酸在玻璃器皿上刻蚀标记
难度: 简单查看答案及解析
-
下列说法或表达正确的是( )
①能导电的物质一定是电解质②氧化还原反应的实质是电子的转移
③蛋白质、漂白粉、苛性钾、液氨分别为纯净物、混合物、强电解质和非电解质
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤酸性氧化物不一定是非金属氧化物,但是碱性氧化物一定是金属氧化物.
A. ①②④ B.①③⑤ C.②④⑤ D.③④⑤
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入CuCl2溶液
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-、Na+
A.①③⑤ B.②④ C.②⑤⑥ D.④⑤
难度: 困难查看答案及解析
-
100mL 1mol•L-1的Ca(HCO3)2溶液中,放入2.3g金属钠充分反应后,有关物质的物理量正确的是(NA表示阿伏加德罗常数)
生成CaCO3
溶液中HCO3-
H2
转移的电子
A
0.1NA
0.1NA
B
1.12L
0.1NA
C
10g
0.05NA
D
10g
0.1NA
难度: 困难查看答案及解析
-
如图是模拟“侯氏制碱法”制取NaHCO3的部分装置。下列操作正确的是( )
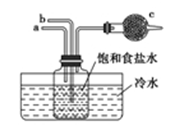
A.a通入CO2,然后b通入NH3,c中放碱石灰
B.b通入NH3然后a通入CO2,c中放碱石灰
C.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉
D.a通入NH3,然后b通入CO2,c中放蘸稀硫酸的脱脂棉
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述不正确的是
A.常温常压下,17g甲基(—14CH3)所含的中子数为8NA
B.0.1molFe与0.1molCl2充分反应,转移的电子数为0.2NA
C.标准状况下,44.8LNO与22.4LO2混合后气体的分子总数为2NA
D.1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.NH4Fe(SO4)2加入过量NaOH溶液中:NH4++Fe3++4OH-=NH3
H2O+Fe(OH)3↓
B.次氯酸钠溶液中通入过量的二氧化硫:ClO-+SO2+H2O=HSO3-+HClO
C.Ba(OH)2溶液和稀硫酸反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D.澄清的石灰水中加入过量的NaHCO3溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是
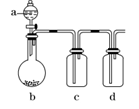
A.若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色
B.若a为浓盐酸,b为MnO2,c中盛品红溶液则c中溶液不褪色
C.若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊
D.若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀
难度: 中等查看答案及解析
-
向22.4g的Fe2O3、Cu的混合物中加入0.5mol/L的硫酸溶液600mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A.4.8g B.6.4g C.2.4g D.1.6g
难度: 中等查看答案及解析
-
下列几组标签被腐蚀的试剂①Al2(SO4)3溶液、KOH溶液②NaAlO2溶液 、H2SO4溶液③NaHCO3溶液、HCl溶液④AgNO3 、氨水⑤CuSO4溶液、NaOH溶液⑥CCl4、NaCl溶液,不用其他试剂,只用胶头滴管和试管就可以鉴别的是
A .①②③④ B.①②④⑤⑥ C.①②③④⑤ D.全部
难度: 中等查看答案及解析
-
下列实验装置正确且能完成实验目的的是

难度: 中等查看答案及解析
-
KClO3与浓盐酸发生如下反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,有关该反应,说法不正确的是
A.被氧化的元素和被还原的元素的质量之比5:1
B.Cl2既是氧化产物,又是还原产物
C.盐酸既体现酸性,又体现还原性
D.转移5mol电子时,产生67.2L的Cl2
难度: 中等查看答案及解析
-
下列叙述错误的是( )
A.10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49%
B.配制0.1mol/L的Na2CO3溶液480mL,需用500ml容量瓶
C.在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水
D.同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6
难度: 中等查看答案及解析
-
O2F2可以发生反应:H2S+4O2F2=SF6+2HF+4O2,下列说法正确的是( )
A.氧气是氧化产物
B.O2F2既是氧化剂又是还原剂
C.若生成4.48LHF,则转移0.8mol电子
D.还原剂与氧化剂的物质的量之比为1:4
难度: 中等查看答案及解析
-
常温下,下列各组物质中,Y既能与X反应又能与Z反应的是
编号
X
Y
Z
①
NaOH溶液
Al(OH)3
稀硫酸
②
KOH溶液
SiO2
浓盐酸
③
O2
N2
H2
④
FeCl3溶液
Cu
浓硝酸
A.①③ B.①④ C.②④ D.②③
难度: 中等查看答案及解析
-
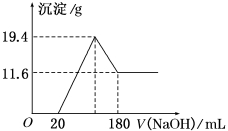
下列图像均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,则其中正确的是( )

A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入二氧化碳至过量
难度: 中等查看答案及解析
-
一定量的CuS和 Cu2S的混合物投入足量的硝酸中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量的NaOH溶液,产生蓝色沉淀,过滤,洗涤,灼烧,得到24.0gCuO.若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为
A.18.0L B.27.0L C.31.4L D.33.6L
难度: 困难查看答案及解析
-
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必需提供下列哪项数据
A.M(OH)2溶液的物质的量浓度 B.与M CO3反应的盐酸的物质的量浓度
C.MCO3的质量 D.题给条件充足,不需要再补充数据
难度: 困难查看答案及解析
-
某无色气体,可能含HCl、CO2、HI、SO2中的一种或几种,将其通入氯水中,得到无色透明溶液。把溶液分成两份,向一份中加入盐酸酸化的BaCl2溶液,出现白色沉淀;另一份中加入硝酸酸化的AgNO3溶液,也有白色沉淀生成。对于原无色气体推断一定正确的是
A.一定存在HCl B.一定存在SO2
C.肯定没有CO2 D.不能肯定是否含有HI
难度: 中等查看答案及解析
-
若以w1和w2分别表示浓度为a mol∙L-1和b mol∙L-1氨水的质量分数,且知2a=b,则下列推断正确的是(氨水的密度比纯水的小)( )
A.2 w1=w2 B.2 w2=w1 C.w2>2 w1 D.w1<w2<2 w1
难度: 困难查看答案及解析
-
向1LFeBr2溶液中,通入1.12L(标准状况下)的Cl2,测得溶液中c(Br一)=3c(Cl一),反应过程中溶液的体积变化忽略不计,则下列说法中正确的是
A.原溶液的浓度为0.1mol/L B.反应后溶液中c(Fe3+)=0.1mol/L
C.反应后溶液中c(Fe3+)=c(Fe2+) D.原溶液中c(Br一)=0.4mol/L
难度: 困难查看答案及解析
-
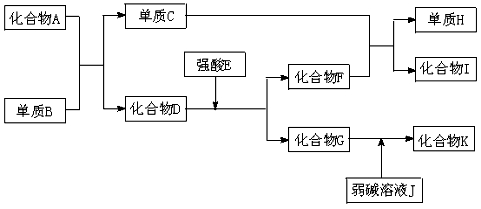
某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:下列说法不正确的是
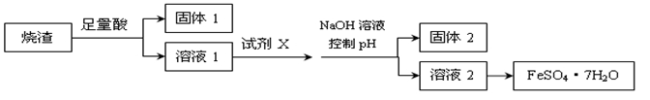
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
难度: 困难查看答案及解析
-
下列有关金属冶炼说法不正确的是
A.电解饱和NaCl溶液制备Na
B.电解熔融的MgCl2制备Mg
C.CO还原赤铁矿(Fe2O3)可用于炼铁
D.Fe和CuSO4溶液的反应可用于湿法炼铜
难度: 简单查看答案及解析
-
已知X、M都是中学教材中的常见元素,(甲) X O3n-+Xn- + H+ →X(单质)+ H2O(未配平);(乙)Mm++mOH -=M(OH)m↓。下列对两个离子反应通式的推断中,正确的是
①若n=1,则XO3n -中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
A.①③ B.②③ C.①② D.④⑤
难度: 困难查看答案及解析