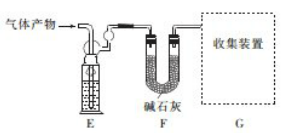
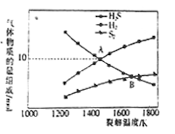
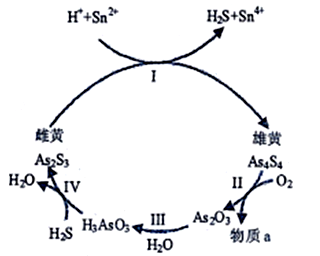
-
下列关于有机化合物的说法不正确的是
A. 1,2-二甲苯也称邻二甲苯
B. 氨基乙酸与a-氨基丙酸的混合物一定条件下脱水能生成4种二肽
C. 苯与溴水不能发生加成反应,所以两者混合后无明显现象
D. C5H10O2属于羧酸的同分异构体有4种
难度: 中等查看答案及解析
-
设NA为阿伏伽徳罗常数的值。下列有关叙述错误的是( )
A. 100g质量分数为46%的乙醇水溶液中氧原子数为4NA
B. 1molCl2通入水中,HClO、Cl-、ClO-粒子数之和小于2 NA
C. 标准状况下,2.24LD2中所含中子的数目是0.2NA
D. 25℃时,KSP(BaSO4)=l×10-10,则BaSO4饱和溶液中Ba2+数目为l×10-5NA
难度: 困难查看答案及解析
-
下列有关说法不正确的是
A. “凡造竹纸……用上好石灰化汁涂浆”,造纸利用了石灰的碱性
B. “曾青(硫酸铜)涂铁,铁赤色如铜”,过程中发生了罝换反应
C. 人民币防伪荧光油墨由颜料与树脂连接料等制成,其中树脂属于有机高分子材料
D. 含钙镁离子的硬水均可通过煮沸的方法使之软化
难度: 中等查看答案及解析
-
下列有关实验操作和结论均正确的是
选项
操作
结论
A
配制FeCl2溶液时加入适量的盐酸
防止Fe2+氧化
B
浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去
“黑面包实验”产生的气体具有还原性
C
制备乙酸乙酯的实验,将蒸出的乙酸乙酯蒸汽导在饱和的NaOH溶液液面以上
防止倒吸,便于分层
D
幼儿使用含NaF的牙膏,可以使牙齿上的[Ca5(PO4)3OH]转化为 [Ca5(PO4)3F],防止蛀牙
Ksp[Ca5(PO4)3F]sp[Ca5(PO4)3OH]
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
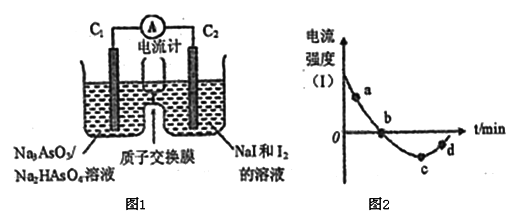
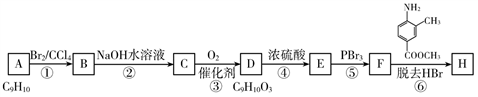
碳酸二甲酯[(CH3O)2CO]是一种具有发展前景的“绿色”化工产品,电化学合成碳酸二甲酯的工作原理如图所示(加入两极的物质均是常温常压下的物质)。下列说法正确的是

A. 电解一段时间后,阴极和阳极消耗的气体的物质的量之比为l:2
B. 石墨l极发生的电极反应为2CH3OH+CO-e-=(CH3O)2CO+H+
C. 石墨2极与直流电源正极相连
D. H+由石墨2极通过质子交换膜向石墨l极移动
难度: 困难查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,b是Y元素的单质,其余为由上述的两种或三种元素组成的化合物。常温时,0.1mol·L-1的a溶液的pH为1, d为红棕色气体,e为无色气体。下列说法正确的是
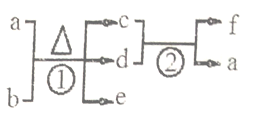
A. 元素的非金属性:Y>Z>X
B. 反应①中消耗lmola时转移电子数与反应②中生成1mol a时转移电子数相等
C. 原子半径的大小:Y<Z<W
D. Y的氢化物常温常压下为气态
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol/L,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
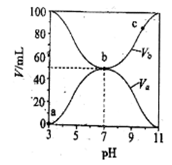
A. Ka(HA)=1×10-6mol/L
B. b点c (B+)=c(A-)=c(OH-)=c(H+)
C. c点时,
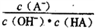 随温度升高而减小
随温度升高而减小D. a→c过程中水的电离程度始终增大
难度: 困难查看答案及解析