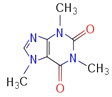
-
设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 28 g乙烯和环丙烷混合气体中的氢原子数为4NA
B. 25℃时,pH=1的H3PO4溶液中含有H+的数目为0.1NA
C. 3 mol H2与1 mol N2于密闭容器中充分反应后,其分子总数为4NA
D. 标准状况下,2.24 L苯在O2中完全燃烧得到CO2分子数为0.6NA
难度: 中等查看答案及解析
-
咖啡酸具有较广泛的抑菌作用,结构简式为
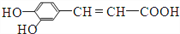 。下列有关说法中正确的是
。下列有关说法中正确的是A. 分子中含有四种官能团
B. 可以用酸性高锰酸钾溶液检验碳碳双键
C. 1 mol咖啡酸与足量钠、碳酸氢钠溶液反应,在相同条件下生成气体的体积比为1∶2
D. 1 mol咖啡酸可与4 mol Br2发生反应
难度: 中等查看答案及解析
-
某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是
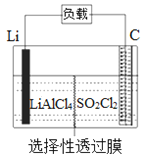
A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e−=2Cl−+SO2↑
难度: 困难查看答案及解析
-
下列实验操作、现象、解释或结论都正确的是
选项
实验操作
实验现象
解释或结论
A
将少量浓硝酸分多次加入
Cu和稀硫酸的混合液中
产生红棕色气体
硝酸的还原产物是NO2
B
某粉末用酒精润湿后,
用铂丝蘸取做焰色反应
火焰呈黄色
该粉末一定不含钾盐
C
将Na2O2裹入棉花中,
放入充满CO2的集气瓶中
棉花燃烧
Na2O2与CO2的反应为放热反应
D
将过量的CO2通入CaCl2溶液中
无白色沉淀出现
生成的Ca(HCO3)2可溶于水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
X、R、Y、Z、M 为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示,R的原子序数大于Z。下列说法错误的是
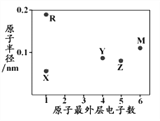
A. R的氧化物只含有离子键
B. 最高价含氧酸的酸性: Y<M
C. 最简单氢化物的稳定性: Y<Z
D. Z的简单氢化物可用作制冷剂
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1 mol/L氨水中逐滴加入相同浓度的盐酸,溶液中pH与pOH的变化关系如右图所示。下列说法错误的是
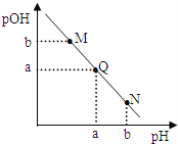
A. 此温度下,水的离子积常数为1.0×10-2a
B. N点溶液加水稀释,
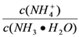 增大
增大C. M、Q、N三点所示的溶液中均存在:c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D. Q点消耗的盐酸的体积等于氨水的体积
难度: 困难查看答案及解析