-
下列电池工作时,O2在正极放电的是( )

难度: 中等查看答案及解析
-
在电解水制取H2和O2时,为了增强液体的导电性,可加入下列物质中的( )
A.HCl B.CuCl2 C.NaOH D.CuSO4
难度: 中等查看答案及解析
-
配制FeCl3溶液时,为防止出现浑浊,可向该溶液中加入少量( )
A.铁 B.盐酸 C.氯化钠 D.氢氧化钠
难度: 简单查看答案及解析
-
工业上常用电解法冶炼的金属是( )
A.钠 B.铁 C.铜 D.银
难度: 简单查看答案及解析
-
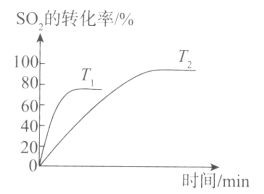
下图表示一定条件下N2+3H2
2NH3的反应速率和时间的关系,其中t1是达到平衡需要的时间,t2~t3是改变一个条件后出现的情况,则该条件可能是( )

A.加压 B.升温
C.加入催化剂 D.增大反应物浓度
难度: 中等查看答案及解析
-
在直流电的作用下,锌板上镀铜时,金属铜作( )
A.阳极 B.阴极 C.正极 D.负极
难度: 简单查看答案及解析
-
氢气可通过下列反应制得:CO(g)+H2O(g)
CO2(g)+H2(g) △H<0,为了提高氢气在平衡体系中所占的比例,可采取的措施是( )
A.减小压强 B.降低温度
C.更换催化剂 D.减小CO的浓度
难度: 中等查看答案及解析
-
下列解释事实的离子方程式不正确的是( )
A.粗铜精炼时,阴极质量增加:Cu2++2e-=Cu
B.明矾可用作净水剂:Al3++3H2O=Al(OH)3↓+3H+
C.用食醋除去水壶中的水垢(CaCO3):2CH3COOH+CaCO3=Ca2++2CH3COO-+CO2↑+H2O
D.向氢氧化镁浊液中滴入酚酞溶液,溶液变红:Mg(OH)2 (s)
Mg2+(aq)+2OH- (aq)
难度: 中等查看答案及解析
-
室温下,关于1 mL pH=13的氨水,下列判断正确的是( )
A.溶液浓度为0.1 mol/L
B.稀释至100 mL时,pH=11
C.加入少量NH4Cl固体,c(OH-)不变
D.加入少量NaOH固体,c(NH4+)减小
难度: 中等查看答案及解析
-
25℃时,浓度相同的Na2CO3和NaHCO3溶液,下列判断不正确的是( )
A.粒子种类不相同 B.c(OH-)前者大于后者
C.均存在电离平衡和水解平衡 D.分别加入NaOH固体,c(CO32-)均增大
难度: 简单查看答案及解析
-
下图为反应:H2(g)+Cl2(g)=2HCl(g)的能量变化示意图,下列说法正确的是( )
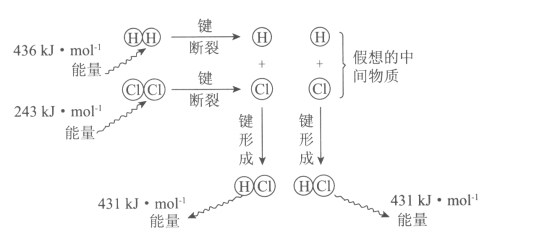
A.该反应的反应热△H=-183kJ·mol-1
B.该反应生成液态HCl比生成气态HCl释放的能量少
C.氯气分子中的化学键比氢气分子中的化学键更稳定
D.1 molHCl分子中的化学键形成时吸收431kJ的能量
难度: 中等查看答案及解析
-
一定条件下,容积为1L的密闭容器中发生反应:
SiF4(g)+2H2O(g)
SiO2(s)+4HF(g) △H=+148.9 kJ·mol-1
下列各项中不能说明该反应已达化学平衡状态的是( )
A.v(SiF4)消耗=4v(HF)生成 B.HF的体积分数不再变化
C.容器内气体压强不再变化 D.容器内气体的总质量不再变化
难度: 中等查看答案及解析
-
如图装置放置一段时间后,铁钉均被腐蚀。下列有关描述错误的是( )
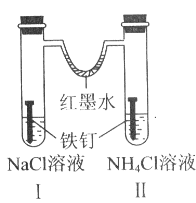
A.红墨水水柱两边的液面变为左低右高
B.I和Ⅱ中负极反应式均为Fe-2e-=Fe2+
C.I中正极反应式为O2+2H2O+4e-=4OH-
D.Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀
难度: 中等查看答案及解析
-
下列有关图1和图2的叙述不正确的是( )

A.均发生了化学能转化为电能的过程
B.Zn和Cu既是电极材料又是反应物
C.工作过程中,电子均由Zn经导线流向Cu
D.相同条件下,图2比图1的能量利用效率高
难度: 中等查看答案及解析
-
取20.00 mL 0.50 mol·L-1 NaOH溶液,恰好将未知浓度的H2SO4溶液20.00 mL滴定至终点,下列说法正确的是( )
A.该实验不需要指示剂
B.用量筒量取上述硫酸的体积
C.H2SO4的浓度为1.00 mol·L-1
D.参加反应的H+和OH-的物质的量相等
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是( )
A.将水加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
为消除NO对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体。
已知:①N2 (g)+O2 (g)
2NO(g) △H=+180.50 kJ·mol-1
②4NH3 (g)+5O2 (g)
4NO(g) +6H2O(g) △H=-905.48 kJ·mol-1
则反应4NH3 (g)+6NO(g)
5N2 (g)+6H2O(g)的△H是( )
A.+2.98 kJ·mol-1 B.-2.98 kJ·mol-1
C.+1807.98 kJ·mol-1 D.-1807.98 kJ·mol-1
难度: 中等查看答案及解析
-
室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )
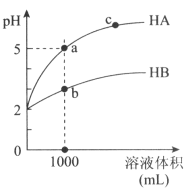
A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则
增大
难度: 困难查看答案及解析
-
在温度t1和t2 (t2>t1)下,X2 (g)和H2反应生成HX的平衡常数如下表:
化学方程式
K(t1)
K(t2)
①
Br2 (g)+H2 (g)
2HBr(g)
5.6×10 7
9.3×106
②
I2 (g)+H2 (g)
2HI(g)
43
34
下列说法不正确的是( )
A.①和②均是放热反应
B.相同条件下,平衡体系中HX所占的比例:①>②
C.其他条件不变时,增大压强可提高X2的平衡转化率
D.其他条件不变时,升高温度可加快HX的生成速率
难度: 中等查看答案及解析
-
电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是( )
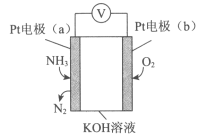
A.溶液中OH-向电极a移动
B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为4:5
D.电极a的反应式为2NH3-6e-+6OH-=N2+6H2O
难度: 中等查看答案及解析
-
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)
CH3OH(g) △H<0。L(L1、L2)、X可分别代表压强或温度,下图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系。

下列说法中,正确的是( )
A.X代表压强 B.L1 <L2
C.平衡常数:K(A)=K(B) D.在C点时,CO转化率为75%
难度: 困难查看答案及解析