-
2017年5月9日,中国科学院等单位已确定第118号元素Og的中文名称为
。
Og的原子结构示意图如图所示,下列有关
Og的说法正确的是

A. 化学性质与
Og几乎相同
B. 原子核内的中子数为294
C. 相对原子质量约为118
D. 位于元素周期表中第七周期Ⅷ族
难度: 简单查看答案及解析
-
下列反应过程中的能量变化与如图相符的是
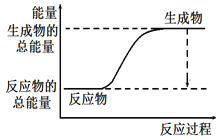
A. 金属钠和水反应
B. 生石灰变成熟石灰的反应
C. 氢氧化钡晶体与氯化铵晶体混合
D. 锌与稀盐酸
难度: 简单查看答案及解析
-
下列说法中正确的一组( )
A.H2和D2互为同位素 B.CH3-CH2-OH与CH3-O-CH3互为同分异构体
C.正丁烷和异丁烷是同素异形体 D.
、
、
互为同素异形体
难度: 中等查看答案及解析
-
下列化学用语或模型表示正确的是
A. CH4的比例模型:
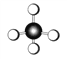
B. NH3的结构式:
C. 35Cl-和37Cl-离子结构示意图均可表示为:
D. 氯化氢的电子式:
难度: 中等查看答案及解析
-
元素周期表和元素周期律可指导人们进行规律性推测和判断。下列说法中不合理的是
A. 若X+和Y2﹣的核外电子层结构相同,则原子序数:X>Y
B. 硅、锗都位于金属与非金属的交界处,都可以做半导体材料
C. 盐酸(HCl)酸性比H2SiO3强,可推断出元素的非金属性:Cl>Si
D. Cs和Ba分别位于第六周期IA和IIA族,碱性:CsOH>Ba(OH)2
难度: 中等查看答案及解析
-
两个烧杯里的溶液为同浓度的稀硫酸,甲中G为电流计。经过一段时间后,以下说法中正确的是
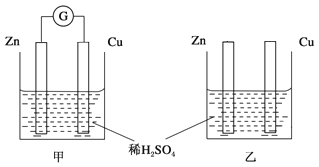
A. 两烧杯中铜片表面均无气泡产生
B. 甲中铜片是阳极,乙中铜片是负极
C. 甲中电子从锌片经溶液流向铜片,实现化学能转化为电能,而乙中实现化学能转化为热能
D. 产生气泡的速率甲比乙快
难度: 中等查看答案及解析
-
E、M、N、Q都是短周期元素,其原子序数依次增大。E原子核内仅含有1个质子;M原子的最外层电子数是次外层的3倍;N的原子半径是短周期元素中最大的;N与Q能够形成NQ型离子化合物。下列说法错误的是
A. 四种元素中只有一种是金属元素 B. Q的最高化合价为+7
C. N的最高价氧化物对应的水化物是一种强碱 D. 离子半径:M<N
难度: 中等查看答案及解析
-
化学与生活息息相关。下列与此有关的说法错误的是
A. 二氧化硫用于食品添加剂时,其主要作用有:去色、杀菌、产生酸味、抗氧化
B. 硫酸钡可用作医疗上的“钡餐”
C. 碳酸氢铵应保存在阴凉处,且不能与碱性肥料混合施用
D. 将植物的秸秆等发酵产生沼气,是人类利用生物质能的一种方式
难度: 简单查看答案及解析
-
推理是化学学习中常用的思维方法,下列推理合理的是
A. NaOH和CaCl2都是离子化合物,所以二者化学键类型相同
B. 可逆反应达平衡时,体系中各组分的浓度不再变化,可推知正、逆反应停止了
C. 原电池加快某些反应的速率,所以用锌与稀硫酸反应制取氢气常加入少量硫酸铜
D. 同条件下反应物浓度越大反应越快,所以铁在浓硝酸中比在稀硝酸中溶解得快
难度: 中等查看答案及解析
-
阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,11.2 L四氯化碳中含有的共价键数为2NA
B. 20g T218O分子中含有的中子数为10N A
C. 0.1 mol NO与O2的混合气体中,所含原子总数为0.2 NA
D. 0.1 mol KI与0.1 mol FeCl3在溶液中反应,转移的电子数为0.1 NA
难度: 中等查看答案及解析
-
下列实验能够达到预期目的的是
A.
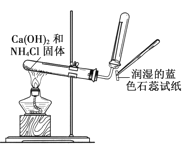 实验室制取氨气并验满
实验室制取氨气并验满B.
 验证化学能转化为电能
验证化学能转化为电能C.
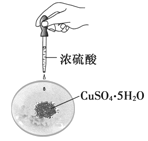 验证浓硫酸的脱水性
验证浓硫酸的脱水性D.
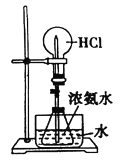 向水槽中加入浓硫酸并打开止水夹引发喷泉
向水槽中加入浓硫酸并打开止水夹引发喷泉难度: 中等查看答案及解析
-
能正确表示各组物质间反应的化学(离子)方程式的是
A. 铜与浓硝酸:Cu+4H++2NO3- =Cu2++2NO2↑+2H2O
B. 氯化铵与氢氧化钠两种稀溶液:NH4++OHˉ=NH3↑+H2O
C. 铜与浓硫酸:Cu+2H2SO4(浓) =CuSO4+SO2↑+2H2O
D. 用稀HNO3溶解FeS固体:FeS+2H+=Fe2++H2S↑
难度: 中等查看答案及解析
-
下列过程中,共价键被破坏的是
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HC1气体溶于水
⑤石英熔化 ⑥NH4C1受热分解 ⑦氢氧化钠熔化 ⑧Na2SO4溶于水
A. ①②④⑥⑦ B. ④⑤⑥ C. ①④⑤⑧ D. ①②⑤⑥⑦
难度: 中等查看答案及解析
-
已知热化学方程式:
①2HI(g)
I2(g)+H2(g) △H=+9.48kJ·molˉ1
②2HI(g)
I2(s)+H2(g) △H=-26.48kJ·molˉ1
下列说法中正确的是
A. ①的反应物比②的反应物稳定
B. I2(s)=I2(g)△H=-35.96 kJ·mol-1
C. ①的产物总能量比②的产物总能量高
D. 1mol I2(s)中通入1mol H2(g),充分反应时吸收26.48kJ热量
难度: 中等查看答案及解析
-
对于100mL1mol/L硫酸与铁片的反应,采取下列措施,其中能使反应速率加快的是
A. 再加入等量的铁片 B. 改用200mL 1.5mol/L盐酸
C. 改用浓硫酸 D. 升高温度
难度: 中等查看答案及解析
-
对水样中M的分解速率的影响因素进行研究。 在相同温度下,M的物质的量浓度[c(M)]随时间(t)的变化如下图所示。下列说法错误的是
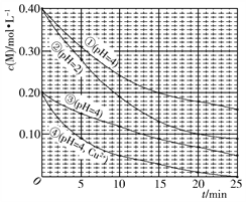
A. 水样酸性越强,M的分解速率越快
B. 水样中添加Cu2+,能加快M的分解速率
C. 由②③得,反应物浓度越大,M的分解速率越快
D. 在0~20 min内,②中M的分解速率为0.015 mol·L−1·min−1
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列说法是正确的是
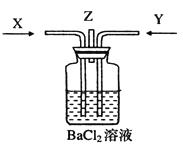
A. 洗气瓶中产生的沉淀是碳酸钡
B. 从Z导管出来的气体中无二氧化碳
C. 洗气瓶中产生的沉淀是碳酸钡和硫酸钡的混合物
D. Z导管口有红棕色气体出现
难度: 中等查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol·Lˉ1 NaOH溶液至铜离子恰好完全沉淀,则消耗NaOH溶液的体积是
A. 15mL B. 30mL C. 45mL D. 60mL
难度: 中等查看答案及解析

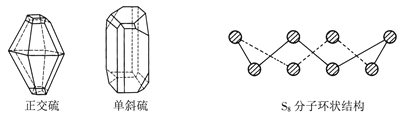
 2NH3,已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2 和H2生成2molNH3过程中的能量变化为________________。
2NH3,已知断裂1molN2中的共价键吸收的能量为946kJ,断裂1molH2中的共价键吸收的能量为436kJ,形成1molNH3中的共价键放出的能量为1173kJ,则由N2 和H2生成2molNH3过程中的能量变化为________________。

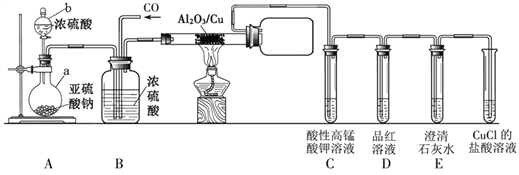
 S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。
S+2CO2。某同学利用如下图所示装置探究上述反应生成的气态产物,部分夹持仪器未画出。