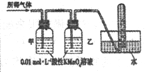
-
《本草纲目拾遗》中在药物名“鼻冲水”条目下写到:贮以玻璃瓶,紧塞其口,勿使泄气,则药力不减。气甚辛烈,触人脑,非有病不可嗅;在“刀创水”条目下写到:治金创,以此水涂伤口,即敛合如故。这里所说的“鼻冲水”、“刀创水”分别指的是
A. 氢氟酸、食盐水 B. 氨水、碘酒 C. 石灰水、硝酸 D. 稀硫酸、食醋
难度: 中等查看答案及解析
-
下列分类或归类正确的是:
①铝热剂、纯净矿泉水、冰水混合物均为混合物 ②NaOH、HD、IBr均为化合物
③明矾、烧碱、硫酸均为强电解质 ④C60、金刚石、石墨均为碳的同素异形体
⑤碘酒、淀粉溶液、水雾、纳米材料均为胶体
A. ①②③⑤ B. ③④⑤ C. ②④⑤ D. ③④
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列叙述正确的是
A.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
B.密闭容器中46gNO2含有的分子数为NA
C.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为2NA
D.标准状况下,1LHCl和1LH2O的物质的量相同
难度: 中等查看答案及解析
-
下列说法正确的是
A. 为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B. 做蒸馏实验时在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即补加
C. 振荡分液漏斗时应关闭其玻璃塞和活塞
D. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
难度: 中等查看答案及解析
-
常温下,下列各组离子或分子在指定溶液中可能大量共存的是
A. pH=7 的溶液:Fe3+、NH4+、Cl-、NO3-
B. 水电离出的c(H+)=1.0×10-7的溶液中:Na+、SO42- 、CO32-、K+
C. 由水电离出的c(OH-)=1.0×10-12mol·L-1的溶液:Cl-、CH3COO-、K+、[Al(OH)4]-
D. c(OH-)/c(H+)=1012的溶液中,NH4+、Al3+、NO3-、Cl-、
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
B.实验室配制的亚铁盐溶液在空气中被氧化:4Fe2++O2+2H2O=4Fe3++4OH-
C.向碳酸氢铵溶液中加过量石灰水并加热:NH4++OH-
NH3↑+H2O
D.用酸化的高锰酸钾溶液氧化双氧水:2 MnO4-+6H++H2O2===2Mn2++3O2↑+4H2O
难度: 困难查看答案及解析
-
知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:
2S2Cl2+2H2O=4HCl+SO2↑+3S↓。对该反应的说法正确的是
A.S2Cl2既作氧化剂又作还原剂 B.H2O作还原剂
C.每生成1mol SO2转移4mol电子 D.氧化产物与还原产物物质的量比为3:1
难度: 中等查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中正确的是
A.依据铝热反应原理,能发生反应2Al+3MgO
3Mg+Al2O3
B.铝合金的大量使用归功于人们能使用焦炭等还原剂从氧化铝中获得铝
C.硫酸铁和明矾都可用于净水
D.Na2CO3可以与胃酸反应,可用Na2CO3治疗胃酸过多
难度: 中等查看答案及解析
-
已知I-、Fe2+、SO2、C1-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-则下列反应不可能发生的是
A. 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
B. I2+SO2+2H2O=H2SO4+2HI
C. 2Fe2++I2==2Fe3++2I-
D. H2O2 +SO2=H2SO4
难度: 中等查看答案及解析
-
向KI溶液中逐滴加入少量CuSO4溶液,观察到有白色沉淀生成,溶液变为淡黄色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列分析中不正确的是
A. 充分反应后的溶液中无Cu2+存在
B. 滴加CuSO4溶液时,每生成1molCuI会转移1mole-
C. 根据上述实验现象可知:Cu2+比SO2的氧化性强
D. 通入SO2时发生反应的离子方程式为SO2+I2+2H2O═2HI+2H++SO42
难度: 困难查看答案及解析
-
在含有FeBr2和FeI2的混合溶液中,通入过量的氯气,然后把溶液加热蒸干、灼烧,最后留下的是
①FeCl2②FeCl3③I2④Br2⑤Fe(OH)3⑥Fe2O3⑦FeO
A.①③④
B.③⑦
C.③⑤
D.⑥
难度: 中等查看答案及解析
-
下列说法错误的是( )
A. 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液
B. 某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物
C. 用过滤法无法除去Fe(OH)3胶体中的FeCl3
D. 向豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质
难度: 简单查看答案及解析
-
下列叙述正确的是
A.金属氧化物不一定是碱性氧化物
B.HC1、H2S、NH3都是电解质
C.强酸强碱都是离子化合物
D.FeBr3、FeCl2、CuS都不能直接用化合反应制备
难度: 简单查看答案及解析
-
用NA代表阿伏加德罗常数的值,下列叙述正确的是
A.11.2LCO和N2混合气体中含有的分子数是0.5NA
B.在氯气参与的反应中,22.4L(标况)氯气完全反应得到的电子数一定为0.2NA
C.1 mol SO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子
D.l L l mol·L
的NaClO溶液中含有ClO
的数目小于NA
难度: 中等查看答案及解析
-
下列说法正确的是
A. 相同条件下,等体积的H2O和CO2含有相同的原子数
B. 等物质的量的Na2O2和Na2O所含阴离子数之比为2:1
C. 质量相等的O3与O2所含电子数相等
D. 相同体积、相同物质的量浓度的酸中氢离子的物质的量相等
难度: 中等查看答案及解析
-
下说法正确的是
A. NaHSO4在熔融的状态下能够导电是因为:NaHSO4=Na++HSO4-
B. pH=l的无色溶液中能大量共存的离子有:CO32-、Na+、Cl-、Ba2+
C. 能用Fe3++3OH-=Fe(OH)3↓表示的化学方程式可以是:
2Fe(NO3)3+3Mg(OH)2=2Fe(OH)3↓+3Mg(NO3) 2
D. 铜片和稀HNO3反应离子方程式为:Cu+4H++NO3-=Cu2++NO↑+2H2O
难度: 困难查看答案及解析
-
下列溶液中,溶质的物质的量浓度是1mol·L-1的是
A. 10 g NaOH固体溶解在水中配成250 mL溶液
B. 80g SO3溶于1 L水配成的溶液
C. 0.5 mol •L-1的NaNO3溶液10 0mL加热蒸发掉50g水的溶液
D. 常溫下,将22. 4 L氯化氢气体溶于水配成1 L溶液
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.次氯酸钙溶液中通入过量CO2:Ca2++2ClO
+CO2+H2O=CaCO3↓+2HClO
B.碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO
==CaCO3↓+2OH
C.NaHCO3溶液中滴加NaOH溶液:HCO3
+OH
=CO
+H2O
D.往FeI2溶液中通入过量氯气:Cl2+2Fe2+==2Cl
+2Fe3+
难度: 中等查看答案及解析
-
硫酸亚铁铵[(NH4)2Fe(SO4)2]是一种重要的化工原料,下列有关说法正确的是
A. Na+、Fe3+、NO3-、C12都可在该物质的溶液中大量共存
B. 向0. 1 mol/L该物质的溶液中逐滴滴加0. 1mol/L NaOH溶液,生成沉淀的物质的量与逐滴加入NaOH溶液体积关系如图所示
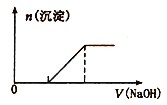
C. 检验该物质中Fe2+是否变质的方法是向该物质的溶液中滴入儿滴KSCN溶液,观察溶液是否变红色
D. 向该物质的溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀的离子方程式为 Fe2++2SO42-+2Ba2++2OH-=2BaSO4↓+Fe(OH)2↓
难度: 极难查看答案及解析
-
已知酸性:H2CO3>HClO>HCO3﹣,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
A.能使pH试纸显深红色的溶液中,Fe3+、Cl﹣、Ba2+、Br﹣能大量共存
B.向溴水中加入足量氯化亚铁溶液能使溶液变成无色
C.向NaClO溶液中通入少量二氧化碳的离子方程式:2ClO﹣+CO2+H2O═2HClO+CO32﹣
D.向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl﹣
难度: 困难查看答案及解析
-
将一定量的氯气通入氢氧化钠浓溶液中,加热一段时间后溶液中形成NaCl、NaClO、NaClO3的共存体系。下列判断正确的是( )
A. 参加反应所需NaOH与氯气的物质的量之比一定为2: 1
B. 反应体系中 n(NaCl):n(NaC1O):n(NaClO3)可能为 11: 2: 1
C. 若有amol氯气参加反应,则amol<转移电子的物质的量<5/3amol
D. 反应中NaClO、NaC1O3为氧化产物,且两者物质的量之比一定为1:1
难度: 困难查看答案及解析
-
根据表中信息,判断下列叙述中正确的是
序号
氧化剂
还原剂
其他反应物
氧化产物
还原产物
①
Cl2
FeBr2
/
Fe3+、Br2
②
KClO3
浓盐酸
/
Cl2
③
KMnO4
H2O2
H2SO4
O2
Mn2+
A. 反应①中,当只有少量Cl2时,Cl2+2Fe2+=2Fe3++2Cl-
B. 氧化性强弱比较:KClO3>Fe3+>Cl2>Br2
C. 表中②组反应的还原产物是KCl,电子转移数目是6e-
D. 表中③组反应的离子方程式为:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
难度: 困难查看答案及解析
-
一块表面已被氧化为Na2O的钠块10.8g,将其投入100g水中,产生H22.24L(标况时),则原来被氧化的钠是
A. 9.2g B. 10.6g C. 6.2g D. 4.6g
难度: 中等查看答案及解析
-
下列有关离子检验的叙述正确的是
选项
操作及现象
结论
A
取少量溶液与试管中,滴加BaCl2溶液,有白色沉淀生成,加稀硝酸沉淀不溶解
溶液中含有Ag+或SO42-
B
取少量溶液与试管中,滴加新制氯水,溶液由无色变为黄色
溶液中含有Br-
C
取少量溶液与试管中,滴加浓氢氧化钠溶液,微热,试管口的红色石蕊试纸变蓝
溶液中含有NH4+
D
取少量溶液与试管中,滴加新制氯水再滴加KSCN溶液,溶液变红色
溶液中含有Fe2+
A. A B. B C. C D. D
难度: 困难查看答案及解析
 (1g以下用游码):
(1g以下用游码):