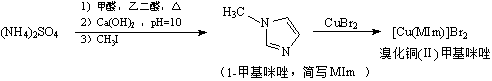
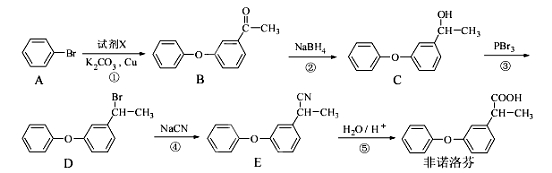
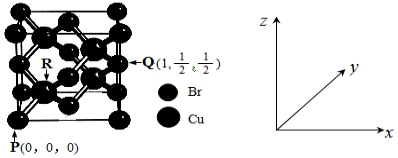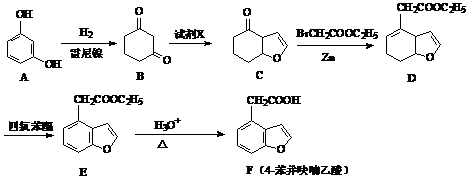-
有人认为CH2=CH2与Br2的加成反应,实质是Br2先断裂为Br+和Br﹣,然后Br+首先与CH2=CH一端碳原子结合,第二步才是Br﹣与另一端碳原子结合.根据该观点如果让CH2=CH2与Br2在盛有NaCl和NaI的水溶液中反应,则得到的有机物不可能是( )
A.BrCH2CH2Br B.ClCH2CH2Cl C.BrCH2CH2I D.BrCH2CH2Cl
难度: 简单查看答案及解析
-
在实验室中,下列除杂(括号内物质为杂质)的方法正确的是
A. 溴苯(溴):加入KI溶液,振荡,分液
B. 乙烷(乙烯):通过盛有KMnO4溶液的洗气瓶
C. 硝基苯(浓HNO3):将其倒入足量NaOH溶液中,振荡、静置,分液
D. 乙烯(SO2):通过盛有溴水的洗气瓶
难度: 中等查看答案及解析
-
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是
A.碳原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的稳定性发生了改变
D.微粒中的键角发生了改变
难度: 中等查看答案及解析
-
下列说法中正确的是
A.
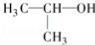 的名称:2﹣甲基乙醇
的名称:2﹣甲基乙醇B. 聚丙烯的链节:—CH2—CH2—CH2—
C. 甲酸甲酯的结构简式:C2H4O2
D. 比例模型为
 的分子可能发生加成反应
的分子可能发生加成反应难度: 中等查看答案及解析
-
W、X、Y、Z均为短周期主族元素,原子序数依次增大。W的最外层电子数、电子层数和主族序数均相等。Y原子最外层电子数与W、X原子最外层电子数之和相等。X原子的最外层电子数是内层电子数的2倍还多1个。Z是所在周期中主族元素原子半径最大的元素。下列说法正确的是( )
A. 离子半径大小顺序为:Z>X>Y>W
B. W、X、Y三种元素都属于非金属元素,它们之间只能形成共价化合物
C. X、Y、Z三种元素与W 元素形成的最简单化合物的沸点依次升高
D. X、Y、Z三种元素形成的化合物的水溶液一定显中性
难度: 简单查看答案及解析
-
有一种星际分子,其分子结构模型如图所示(图中球与球之间的连线代表化学键,如单键、双键、三键等,不同花纹的球表示不同的原子)。
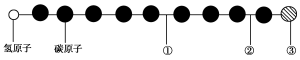
对该物质判断正确的是 ( )
A.①处的化学键是碳碳双键
B.②处的化学键是碳碳三键
C.③处的原子可能是氯原子或氟原子
D.②处的化学键是碳碳单键
难度: 中等查看答案及解析
-
NA代表阿伏伽德罗常数。已知C2H4和C3H6的混合物的质量为ag,则该混合物
A.所含共用电子对数目为(a/7+1)NA B.所含碳氢键数目为aNA/7
C.燃烧时消耗的O2一定是33.6a/14L D.所含原子总数为aNA/14
难度: 中等查看答案及解析
-
两种气态烃组成的混合气体完全燃烧后所得到CO2和H2O的物质的量随混合烃总物质的量的变化如图所示.下列有关混合气体的说法正确的是
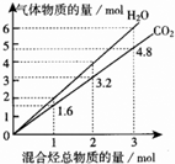
A.该混合气体中一定含有乙烯
B.该混合气体一定含有甲烷和乙炔
C.在110℃条件下,混合气体与氧气混合,总混合气燃烧前后体积不变
D.若混合气体由CH4和C2H4组成,则其体积比为1:3
难度: 极难查看答案及解析
-
β﹣月桂烯的结构如图所示
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有
A.2种 B.3种 C.4种 D.6种
难度: 中等查看答案及解析
-
下列化学用语表述一定正确的是
A.甲醛的电子式:
B.苯酚钠溶液中中通入少量二氧化碳气体:
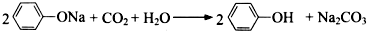
C
.溴乙烷与氢氧化钠水溶液共热:
D.乙醇与灼热的氧化铜反应:CH3CH2OH+CuO
CH3CHO+Cu+H2O
难度: 中等查看答案及解析
-
具有下列电子层结构的原子和离子,其对应元素一定属于同一周期的是
A. 两原子核外全部都是s电子
B. 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子
C. 原子核外M层上的s、p能级都充满电子,而d能级上没有电子的两种原子
D. 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子
难度: 中等查看答案及解析
-
“神舟七号”的燃料是氢化锂三兄弟——LiH、LiD、LiT。其中Li的质量数为7,对这三种物质的下列说法正确的是( )
A. 质子数之比为1:2:3 B. 中子数之比为1:1:1
C. 摩尔质量之比为8:9:10 D. 化学性质不相同
难度: 中等查看答案及解析
-
合成导电高分子材料PPV的反应
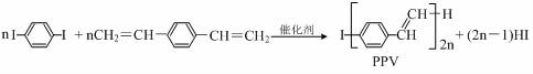
下列说法正确的是:
A.PPV是聚苯乙炔
B.该反应为缩聚反应
C.PPV与聚苯乙烯的最小结构单元组成相同
D.1 mol
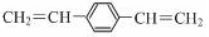 最多可与2 mol H2发生反应
最多可与2 mol H2发生反应难度: 困难查看答案及解析
-
某一有机物A可发生下列变化:已知C为羧酸,且C、E不发生银镜反应,则A的可能结构有
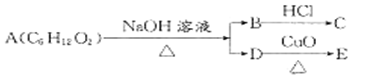
A.4种 B.3种 C.2种 D.1种
难度: 困难查看答案及解析
-
NM3和D 58是正处于临床试验阶段的小分子抗癌药物,结构如下:
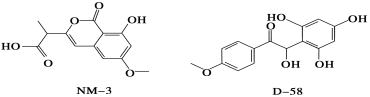
关于NM3和D58的叙述,错误的是
A.都能与NaOH溶液反应,原因不完全相同
B.都能与溴水反应,原因不完全相同
C.都不能发生消去反应,原因相同
D.遇FeCl3溶液都显色,原因相同
难度: 中等查看答案及解析
-
核黄素又称维生素B2,可促进发育和细胞再生,有利于增进视力,减轻眼睛疲劳。核黄素分子的结构为
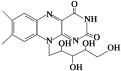
已知:
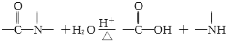
有关核黄素的下列说法中,不正确的是
A、该化合物的分子式为C17H22N4O6
B、酸性条件下加热水解,有CO2生成
C、酸性条件下加热水解,所得溶液加碱后有NH3生成
D、能发生酯化反应
难度: 中等查看答案及解析
-
下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据,下列说法正确的是
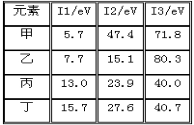
A. 甲的金属性比乙弱
B. 乙的化合价为+1价
C. 丙一定为非金属元素
D. 丁一定是金属元素
难度: 中等查看答案及解析
-
下列方法或操作正确且能达到预期目的的是
序号
实验目的
方法及操作
①
比较水和乙醇中羟基氢的活泼性强弱
用金属钠分别与水和乙醇反应
②
证明CH2=CHCHO中含有碳碳双键
滴入KMnO4酸性溶液,看紫红色是否褪去
③
证明蛋白质在某些无机盐溶液作用下发生变性
向鸡蛋清溶液中加入饱和硫酸铜溶液,有沉淀析出;再把沉淀加入蒸馏水中
④
检验溴乙烷中的溴元素
将少量溴乙烷与NaOH溶液混合共热,充分反应并冷却后,向溶液中加稀HNO3酸化,再滴加AgNO3溶液
A. ①②④ B. ②③④ C. ②③④ D. ①③④
难度: 中等查看答案及解析
-
我国药学家屠呦呦因发现植物黄花蒿叶中含有抗疟疾的物质﹣青蒿素而荣获2015年诺贝尔奖.科学家对青蒿素的结构进行进一步改良,合成药效更佳的双氢青蒿素、蒿甲醚.下列说法不正确的是
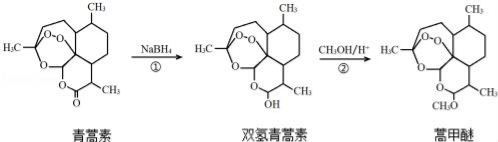
A. 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式
B. 双氢青蒿素在水中的溶解性大于青蒿素
C. ①、②的反应类型分别为还原反应、取代反应
D. 青蒿素转化为双氢青蒿素,手性碳个数不变
难度: 中等查看答案及解析
-
过量的下列溶液与水杨酸(
)反应能得到化学式为C7H5O3Na的是A.NaHCO3溶液 B.Na2CO3溶液 C.NaOH溶液 D.NaCl溶液
难度: 中等查看答案及解析
-
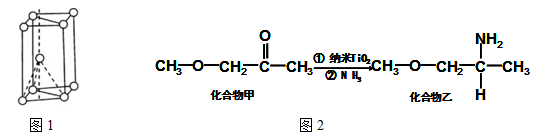
已知
,如果要合成
,所用的起始原料可以是
A、2甲基1,3丁二烯和1丁炔
B、1,3戊二烯和2丁炔
C、2,3二甲基1,3戊二烯和乙炔
D、2,3二甲基1,3丁二烯和丙炔
难度: 中等查看答案及解析
-
化学是一门以实验为基础,研究物质的组成、结构、性质及其变化规律的自然科学。学习科学研究的基本方法,可以加深对科学本质的认识,增进对物质世界的认识。下列有关叙述不正确的是
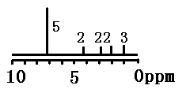
A. 用测定接近水的沸点的水蒸气相对分子质量的方法可知水分子间可以形成氢键
B. 相对分子质量的测定常用质谱仪,在质谱仪内,有机化合物分子在高真空环境下被高能电子束轰击后主要形成带负电的碎片
C. 利用红外光谱、核磁共振氢谱等现代物理方法或化学方法均可测定C2H6O的分子结构
D. 某有机物分子式为C11H14O2,其H—NMR图谱如右图(峰右侧或上面的数字表示H的个数,且知:7.2ppm(5H)为苯基),可推测该有机物可能为
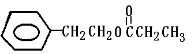
难度: 中等查看答案及解析
-
某化合物的结构(键线式)及球棍模型如图:
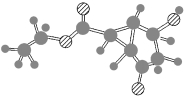
下列关于该有机物的叙述正确的是
A. 该有机物中发生SP3杂化的碳原子有7个
B. 该有机物中不含SP2杂化的碳原子
C. 键线式中的Et代表的基团为-CH3
D. 构成环的所有的碳原子可能在同一个平面上
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其它元素均不位于同一主族,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0。下列说法正确的是
A. M的氢化物的水溶液能与W的钠盐溶液反应得到W的氢化物,说明非金属性M > W
B. 原子半径的大小顺序:r(W)>r(Z)>r(Y)
C. Y与Z形成的化合物能与碱反应,但不能和任何酸反应
D. X和Y,W和M均能形成原子个数比为1:1的分子
难度: 中等查看答案及解析