-
短周期主族元素X、Y、Z、W原子序数和族序数均依次增大,其中只有Y、Z处于同一周期,Z是空气中含量最多的元素。下列说法正确的是
A. X、Z两种元素形成的化合物中可能既含极性键,又含非极性键
B. 原子半径: r(Y)<r(Z)
C. W的氧化物对应的水化物一定是强酸
D. W的气态氢化物与W的最高价含氧酸在任何条件下都不反应
难度: 困难查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 过量氯气通入溴化亚铁溶液中2Cl2+Fe2++2Br-=4Cl-+Fe3++Br2
B. 向CuSO4溶波中加入Na2O2: 2Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
C. 向Na2SiO3溶液中通入过量SO2: SiO32-+SO2+2H+=H2SiO3↓+SO32-
D. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H'=SO2↑+H2O
难度: 困难查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是
选项
实验目的
实验操作
A
称取3.0gNaOH固体
先在托盘上各放一个小烧杯,然后在右盘上添加3g砝码,左盘上添加NaOH 固体
B
制Fe(OH)3 胶体
将FeCl3 浓溶液滴入沸水中,并不断搅拌
C
除去Cu中混有的少量Si
将固体混合物溶于过量的NaOH溶液中,然后过滤、洗涤、干燥
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
往200mLFeCl3溶液中通入4.48L标难状况下的H2S气体后(气体完全反应),再加入过量的Fe粉,反应停止后,测得溶液中含有1.2mol金属阳离子,下列说法正确的是
A. 通入H2S时发生反应的离子方程式为Fe3++H2S=Fe2++S↓+2H+
B. 若将加入Fe粉后溶液中的1.2mol金属阳离子完全氧化,需要通入Cl213.44L
C. 若将上述4.48L标准状况下的H2S换成0.2molNa2S,加入过量的Fe粉后溶液中也能得到1.2mol金属阳离子
D. 将原FeCl3溶液加热蒸干并灼烧,得到固体的质量为64g
难度: 困难查看答案及解析
-
有以下六种饱和溶液①CaCl2;②Ca(OH)2;③Na2SiO3;④Na2CO3;⑤NaAlO2;⑥NH3和NaCl,分别持续通入CO2,最终不会得到沉淀或析出晶体的是( )
A. ①② B. ③⑤ C. ①⑥ D. ④⑥
难度: 困难查看答案及解析
-
不论以何种比例混合,将甲和乙两种混合气体同时通入过量的丙溶液中,一定能产生沉淀的组合是
序号
甲
乙
丙
①
CO2
SO2
石灰水
②
Cl2
CO2
CaCl2
③
CO2
SO2
Ba(NO3)2
④
NO2
SO2
BaCl2
⑤
CO2
NH3
CaCl2
A. ②③④ B. ②③④⑤ C. ①③④ D. ①③④⑤
难度: 困难查看答案及解析
-
NA代表阿伏加德罗常数的值。下列叙述正确的是(相对原子质量:Fe---56)
A. 钢铁发生析氢腐蚀时,0.56gFe反应 转移电子数为0.03NA
B. 1L 0.1mol·L-1的NaHCO3溶液中HCO3- 和CO32-离子数之和为0.1NA
C. 1molH2O2分子中的非极性共价键 1NA
D. 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4 NA
难度: 困难查看答案及解析
-
下列离子反应方程式正确的是
A. 向Na2SiO3溶液中通入过量SO2:SiO32—+ SO2+ H2O=H2SiO3↓+SO32—
B. 碳酸氢镁溶液中加入过量石灰水:Mg2++2HCO3-+Ca2+ +2OH- =CaCO3↓+2H2O+MgCO3↓
C. 往FeCl3溶液中通入H2S气体:2Fe3+ + H2S = 2Fe2++ S↓+ 2H+
D. 大苏打溶液中加入稀硫酸:S2O32—+2SO42—+6H+ =4 SO2↑+3H2O
难度: 困难查看答案及解析
-
下列各图与表述一致的是( )

A. 图①表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A
B. 用图②所示装置蒸发FeCl3溶液制备无水FeCl3
C. 图③可以表示向一定量的明矾溶液中逐滴滴加一定浓度氢氧化钡溶液时产生Al(OH)3沉淀的物质的量变化
D. 图④电解饱和食盐水的装置中,溶液B为浓氢氧化钠溶液
难度: 困难查看答案及解析
-
某温度下,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO(g)+Br2(g)
2NOBr(g)(正反应放热)。下列说法正确的是
容器
编号
物质的起始浓度(mol/L)
物质的平衡浓度(mol/L)
c(NO)
c(Br2)
c(NOBr)
c(NOBr)
I
0.3
0.15
0.1
0.2
II
0.4
0.2
0
III
0
0
0.2
A. 容器II达平衡所需的时间为4min,则v(Br2)=0.05mol/(L•min)
B. 达平衡时,容器I与容器III中的总压强之比为2:1
C. 升高温度,逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
D. 达平衡时,容器II中c(Br2)/c(NOBr)比容器III中的小
难度: 困难查看答案及解析
-
我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是
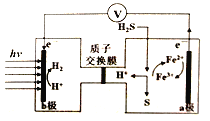
A. 该制氢工艺中光能最终转化为化学能
B. 该装置工作时,H+由b极区流向a极区
C. a极上发生的电极反应为Fe3++e-=Fe2+
D. a极区需不断补充含Fe3+和Fe2+的溶液
难度: 困难查看答案及解析
-
已知33As是第VA族元素,与35Br位于同一周期,下列关系正确的是( )
A. 还原性:
B. 热稳定性:
C. 原子半径:
D. 酸性:
难度: 困难查看答案及解析
-
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l)
H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法不正确的是
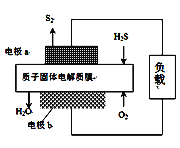
A. 电路中每流过2mol电子,电池内部释放316kJ热能
B. 每34gH2S参与反应,有2mol H+经质子膜进入正极区
C. 电极a为电池的负极
D. 电极b上发生的电极反应为:O2+4e
+4 H+=2H2O
难度: 困难查看答案及解析
-
25 ℃时,体积均为20 mL、浓度均为0.1mol·L-1的两种酸HX、HY 分别与0.1mol·L-1的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是( )
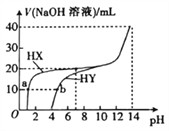
A. Ka(HY)的数量级约为10-3
B. a点c(X-)>b点c(Y-)
C. HX发生反应的离子方程式为HX +OH-=X-+H2O
D. pH=7时,两种反应后的溶液中c(Y- )>c(X-)
难度: 困难查看答案及解析
-
一种钌(Ru)基配合物光敏染料敏化太阳能电池的原理及电池中发生的主要反应如图所示。下列说法正确的是( )
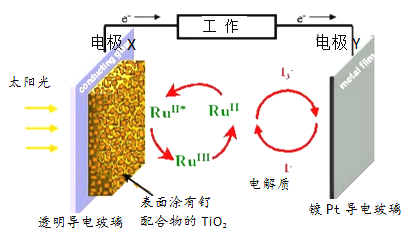
A. 镀铂导电玻璃的作用是传递I-
B. 电池工作时,光能转变为电能,X 为电池的正极
C. 电解质溶液中发生反应:2Ru3++3I-=2Ru2++I3-
D. 电池的电解质溶液中I-和I3-的浓度均不断减小
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A. Fe3O4 溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O
B. 硫化钠的水解反应:S2-+H3O+
HS-+H2O
C. 将0.2mol/L的NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2A1(OH)3↓+3BaSO4↓
D. NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
难度: 困难查看答案及解析
-
用下图所示装置除去含有CN-、Cl-废水中的CN-时,控制溶液的pH值为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
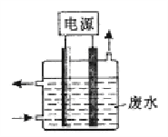
A. 用石墨作阳极,铁作阴极
B. 阳极的电极反应式为:Cl-+2OH--2e-=== ClO-+H2O
C. 阴极附近碱性增强,阳极附近碱性减弱
D. 除去CN-的反应:5ClO-+2CN-+2H+ === N2↑+2CO2↑+5Cl-+H2O
难度: 困难查看答案及解析
-
已知H2A为二元弱酸,20℃时,配制一组c(H2A)+c(HA-)+c(A2-)=0.100mol/L的H2A和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法错误的是
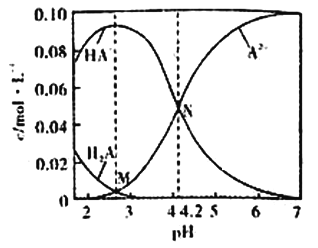
A. Ka2(H2A)的数量级为10-5
B. NaHA溶液中:c(H+)>c(OH-)
C. M点由水电离出的c(H+)>N点由水电离出的c(H+)
D. pH=7的溶液中:c(Na+)>2c(A2-)
难度: 困难查看答案及解析
-
将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 标准状况下,反应过程中得到6.72L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8g的沉淀
D. 最终得到的溶液中c(Na+)=1.5mol·L-1
难度: 困难查看答案及解析
-
甲、乙、丙、丁分别为A、B、C、D 四种短周期元素的最高价氧化物对应的水化物,已知0.1mol·L-1甲、丙、丁溶液的pH 与A、C、D 的原子序数关系如图所示(lg2=0.3),且常温下甲、丙、丁均可与乙反应。下列说法正确的是
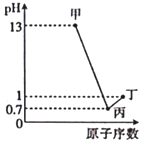
A. 原子半径:A<B<C<D
B. A、B 分别与D 形成的化合物均为离子化合物
C. B、C 的简单离子都会影响水的电离平衡
D. 乙在浓氨水中能溶解
难度: 困难查看答案及解析
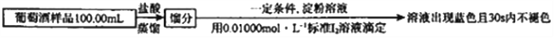
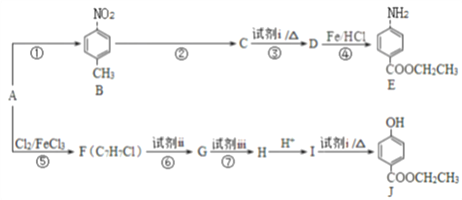

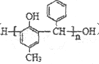 ),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。
),写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):_______________。