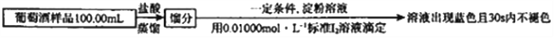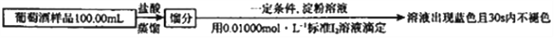-
硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
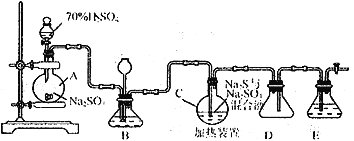
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
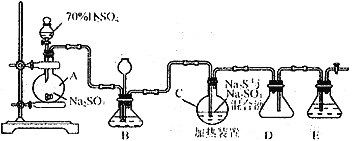
烧瓶C 中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S (aq) (Ⅰ)
2H2S (aq) +SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)  Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A 中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5) 是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
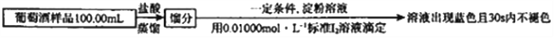
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI 可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI 被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
-
硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:
烧瓶C 中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S (aq) (Ⅰ)
2H2S (aq) +SO2(g)= 3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq)  Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A 中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5) 是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
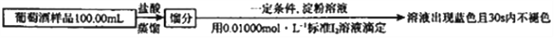
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI 可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI 被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
-
(共16分)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一)硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。
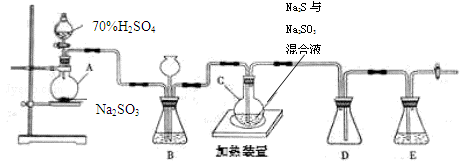
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)= Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)= 3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:_______________________________。
装置D的作用是 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是__________________。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
其原因是 (用化学方程式表示)
-
(共16分)硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,在工业上有广泛的应用。它们对应的钠盐同样也是重要的化工产品。
(一).硫代硫酸钠(Na2S2O3)可用做分析试剂及鞣革的还原剂,它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如下装置(略去部分加持仪器)模拟生成过程。

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)= Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)= 3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq) Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)烧瓶A中发生反应的离子方程式为:_______________________________。
装置D的作用是 。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有 。
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
(4)为了保证硫代硫酸钠的产量,实验中通入SO2不能过量,原因是__________________。
(二)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH
b.加入Ba(OH)2溶液
c.加入盐酸
d.加入品红溶液
e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
其原因是 (用化学方程式表示)
-
硫代硫酸钠(Na2S2O3)是重要的化工原料,可用作分析试剂及鞣革的还原剂,易溶于水,受热、遇酸易分解。Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。工业上常利用含硫废水生产Na2S2O3·5H2O,某化学兴趣小组在实验室中用如图所示装置(加热装置及部分夹持装置已略去)模拟其生产过程并探究其化学性质。
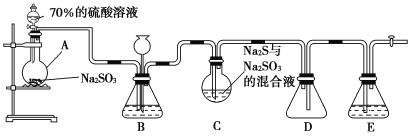
烧瓶C中发生如下反应:
Na2S(aq)+H2O(l)+SO2(g)=Na2SO3(aq)+H2S(aq) ①
2H2S(aq)+SO2(g)=3S(s)+2H2O(l) ②
S(s)+Na2SO3(aq) Na2S2O3(aq) ③
Na2S2O3(aq) ③
Ⅰ.制备Na2S2O3·5H2O
(1)加入药品之前须进行的操作是_________;装置D的作用是______________;装置B的作用之一是观察SO2的生成速率,其中的试剂最好选用________(填字母)。
A.蒸馏水 B.饱和Na2SO3溶液
C.饱和NaHSO3溶液 D.饱和NaHCO3溶液
(2)为保证硫代硫酸钠的产量,实验中产生的SO2不能过量,原因是_________;所制得的粗产品可以通过________方法进一步提纯得到纯Na2S2O3·5H2O。
Ⅱ.测定产品纯度
准确称取w g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.10 mol·L-1I2的标准溶液滴定。反应原理为2S2O32-+I2=S4O62-+2I-。
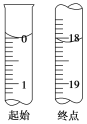
(3)滴定至终点时的现象:______________。滴定起始和终点时I2的标准溶液液面位置如图所示,则消耗I2的标准溶液的体积为________mL。产品的纯度为________(设Na2S2O3·5H2O的相对分子质量为M,列出用M、w表示的表达式)。
Ⅲ.探究Na2S2O3的部分化学性质
(4)(提出假设)
假设一:Na2S2O3与Na2SO4的结构相似,化学性质也应该相似,因此,室温时Na2S2O3溶液的pH=7。
假设二:从S的化合价推测Na2S2O3具有较强的还原性。
(验证假设) 配制适量Na2S2O3溶液,进行如下实验,请将实验补充完整。
| 实验操作 | 实验结论 或现象 | 现象解释(用离子 方程式表示) |
| 假设一 | ________ | 溶液pH=8 | ________ |
| 假设二 | 向溴水中 滴入适量 Na2S2O3 溶液 | 溴水褪色 | ________ |
实验结论:________________________________________。
Ⅳ.Na2S2O3的应用
(5)Na2S2O3的商品名为“海波”,俗称“大苏打”,化学上常用于滴定实验。为测定某K2Cr2O7溶液的浓度,研究小组的同学准确量取10.00 mL K2Cr2O7溶液于锥形瓶中,加入过量KI固体和适量稀H2SO4,滴加几滴指示剂,用0.10 mol·L-1 Na2S2O3标准溶液滴定至终点,进行3次平行实验后,测得平均消耗Na2S2O3溶液的体积为30.00 mL,则c(K2Cr2O7)=________mol·L-1。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2S2O32-+I2=S4O62-+2I-)
Ⅴ.探究与反思
(6)为验证产品中含有Na2SO3和Na2SO4,该小组设计了以下实验方案,请将实验方案补充完整。
取适量产品配成稀溶液,___________________(所需试剂从BaCl2溶液、稀HNO3、稀H2SO4、稀盐酸、蒸馏水中选择)。
-
硫有多种含氧酸,如亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸、硫代硫酸(H2S2O3)等,其中硫酸最为重要,在工业上有广泛的应用。完成下列计算:
(1)浓硫酸与铜在加热时发生反应,生成二氧化硫气体的体积为4.48 L(标准状况),若将反应后的溶液稀释至500 mL,该溶液中硫酸铜的物质的量浓度为__________ mol·L-1。
(2)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸,若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为____________ mol·L-1。
-
(本题共14分)
硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用。在实验室,浓硫酸是常用的干燥剂。
完成下列计算:
(1)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为________mol/。
(2)若以浓硫酸吸水后生成的H2SO4·H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:
3FeS2+8O2→Fe3O4+6SO2 4FeS2+11 O2→2Fe2O3+8SO2
若48mol FeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比。
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法。
硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体)。(已知空气组成:N2体积分数0.79、O2体积分数0.21)
-
硫代硫酸钠(Na2S2O3)俗名大苏打,可用做分析试剂。它易溶于水,难溶于酒精,受热、遇酸易分解。工业上可用硫化碱法制备,反应原理:2 Na2S + Na2CO3 + 4SO2 = 3 Na2S2O3 + CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:

开启分液漏斗a,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
(1)b装置的名称是 ,b中反应的离子方程式为____________________。
(2)反应开始后,c中先有浑浊产生,后又变为澄清,此浑浊物是____________。
(3)控制b中的溶液的pH接近7,停止通入SO2。若未控制好pH<7,会影响产率,原因是(用离子方程式表示) 。
(4)停止通入SO2后,将c中的溶液抽入d中,d中的试剂为_________________。
(5)将d所得液溶转移到蒸发皿中,水浴加热浓缩,冷却结晶、过滤、洗涤,洗涤晶体所用的试剂为(填化学式) 。
(6)为检验制得的产品的纯度,该实验小组称取5.0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:。在锥形瓶中加入25mL 0.01mol/L KIO3 溶液,并加入过量的KI酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当达到滴定终点时,消耗Na2S2O3溶液20.00mL,则该产品的纯度是 。(用百分数表示,保留1位小数)
-
(9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
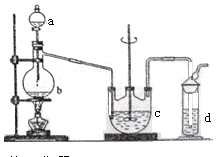
(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
-
硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。

(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。

(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。

Na2S2O3(aq) (Ⅲ)