-
有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。
(1)岩脑砂的制备
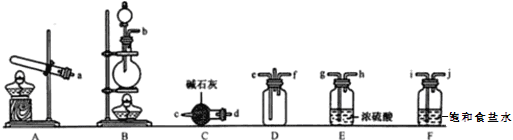
①写出装置B中反应的化学方程式:_____________________________。
②装置C的仪器名称是_____________,装置F的作用是______________________。
③为了使氨气和氯(在D中充分混合,上述装置的合理连接顺序:_______→e f←_______(用小写字母和箭头表示,箭头方向与气流方向一致)。
④证明氨气和氯气反应有NH4Cl生成,需要的检验试剂中除了蒸馏水、稀硝酸、硝酸银溶液、红色石蕊试纸外,还需要_______________________。
(2)岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热
(发生的反应为:2NH4Cl+3CuO 3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。
3Cu+N2↑+2HC1+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的物质的量之比。

①装置H中盛装的试剂是_____________,其作用是_____________________。
②若装置I增重bg,利用装置K测得气体体积为V L(已知常温常压下气体摩尔体积为24.5L·mol-l),则岩脑砂中n(N)∶n(Cl)=_________(用含b、V 的代数式表示,不必化简)
③若取消J装置(其它装置均正确),n(N)∶n(Cl)比正常值________(填“偏高”“偏低”或“无影响”)。
-
兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金,被广泛用作有机物的氢化反应的催化剂。以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下图所示:
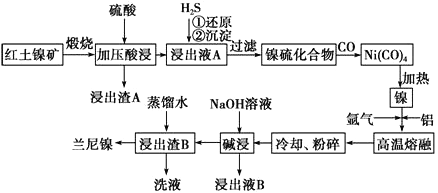
(1)浸出渣A的主要成分是_______________(填化学式)。
(2)已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有大量Ni2+,写出有关镍元素的加压酸浸的化学反应方程式_______________________________。
(3)向浸出液A中通入H2S气体,①还原过程中所涉及主要反应的离子方程式是__________________________________。
(4)在形成Ni(CO)4的过程中,碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为________。 (5)“碱浸”的目的是使镍产生多孔结构,从而增强对氢气的强吸附性,此过程中发生反应的离子方程式为__________________________。
(6)常温时,向浓度均为1.0mol·L-1的FeSO4、NiSO4的混合溶液中滴加Na2S 固体,当Ni2+恰好沉淀完全时,所得溶液中c(Fe2+)=______________。
(已知:①25℃,Ksp(NiS)=2.0×10-21、Ksp(FeS)=6.0×10-18
②溶液中的离子浓度≤10-5 mol·L-1时,认为该离子沉淀完全。)
(7)浸出液B可以回收,重新生成铝以便循环利用。请设计简单的回收流程:
浸出液B→___________________________________________________________。 (箭头上注明外加反应物的化学式和反应条件)。(示例: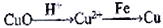 )
)
-
中国政府承诺,到2020年,单位GDP二氧化碳排放比2005年下降40%-50%。减少CO2 排放是一项重要课题。
(1)以CO2为原料抽取碳(C)的太阳能工艺如右图所示。
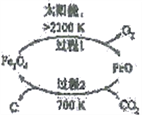
①过程1中每生成1mol FeO转移电子数为____________。
②过程2中发生反应的化学方程式为________________________________。
(2)CO2在新型钴基电催化剂作用下,转化为清洁燃料——甲酸。其工作原理如下图所示,写出生成甲酸的电极反应式:____________。
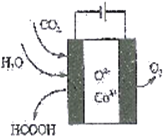
(3)航天员呼吸产生的CO2用下列反应处理,可实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
水电解反应:2H2O(l) 2H2(g)+O2(g)
2H2(g)+O2(g)
将原料气按n(CO2)∶n(H2)=1∶4 置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如下图所示(虚线表示平衡曲线)。
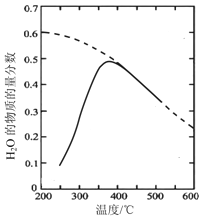
①温度过高或过低均不利于该反应的进行,原因是____________________________________。
②200℃达到平衡时体系的总压强为p,该反应平衡常数的计算式为________________(不必化简,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(4)一种新的循环利用方案是用Bosch反应CO2(g)+2H2(g) C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
①已知CO2(g)、H2O(g)的生成焓分别为-394 kJ·mo1-l、-242 kJ·mo1-l,Bosch反应的ΔH=__________ kJ·mo1-l。(生成焓指一定条件下由对应单质生成1mol 化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是______________________________。
③新方案的优点是_________________________。
-
【化学——选修3:物质结构与性质】已知Fe、HCN与K2CO3在一定条件下发生如下反应:Fe+6HCN+2K2CO3=K4Fe(CN)6+H2↑+2CO2↑+2H2O,回答下列问题:
(1)金属铁的紧密堆积方式为_______________,其配位数为_____________________。
(2)HCN 分子的结构式为___________,与CN-互为等电子体的阴离子是_________________。
(3)K2CO3中阴离子的空间构型为_______________,CO2为_____________分子(填“极性”或“非极性”),H2O中O原子的杂化轨道类型为_______________。
(4)配合物K4Fe(CN)6的中心离子的电子排布式为__________________。
(5)上述化学方程式中C、N、O的第一电离能由小到大的顺序为________________________。
(6)冰的晶体结构模型如图1,它的晶胞与金刚石的晶胞相似,如图2,水分子之间以氢键相连接,在一个晶胞中有_____个氢键,若氢键键长为d nm,则晶体密度(g·cm-3)计算式为___________ (用NA 表示阿伏加德罗常数的值。)

-
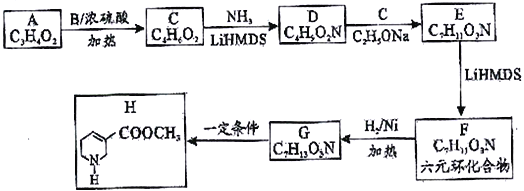
【化学一选修5:有机化学基础】由羧酸A (C3H4O2) 经过如下合成路线获得药物中间体H。
已知:Ⅰ.R1CH=CH1+RNH2 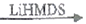 R1CH2CH2NHR(R可以是氢原子或烃基)
R1CH2CH2NHR(R可以是氢原子或烃基)
Ⅱ.R1COOR2+R3CH2COOR4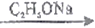
 +R2OH
+R2OH
请回答:
(1)化合物A 的名称_________________,B的结构简式_______________。
(2)写出药物中间体H中两种官能团的名称_______________________。
(3)已知D的结构简式:H2N-CH2-CH2-COOCH3,D→E的反应类型________________,F→G的反应类型_________________。
(4)写出E→F的化学方程式______________________________________。
(5)写出化合物D符合下列条件的所有可能的同分异构体的结构简式_______(任写两种即可)
①分子中含六元环。
②红外光谱显示分子中含有碳氮单键。
③核磁共振氢谱显示分子中有3种化学环境不同的氢原子。
(6)设计由乙酸甲脂合成聚合物: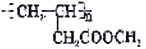 的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
C1
可以表示羟基,也可以表示氢氧根离子




HCO3-+CH-



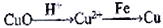 )
)

 2H2(g)+O2(g)
2H2(g)+O2(g)


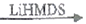 R1CH2CH2NHR(R可以是氢原子或烃基)
R1CH2CH2NHR(R可以是氢原子或烃基)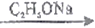
 +R2OH
+R2OH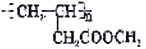 的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。
的单体的合成路线(其他试剂任选)。(用流程图表示)____________________________。