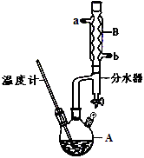
-
化学与生活密切相关,下列说法正确的是
A.生活中常用热的小苏打去污,利用了水解吸热的特点
B.Mg可由电解MgCl2水溶液制取,Al可由电解熔融Al2O3制取
C.少数商贩在蔬菜表面洒少许福尔马林,可延长保鲜时间
D.SiO2可用来制作光导纤维,但SiO2本身不导电
难度: 简单查看答案及解析
-
分子式为C4H8属于链状烃的一溴代物的数目有
A.7 B.8 C.9 D.10
难度: 困难查看答案及解析
-
下列实验操作或方案正确的是
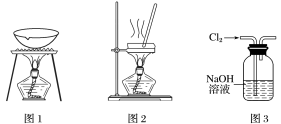
A.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液和浓硫酸的洗气瓶
B.用图1所示装置可从KI和I2的固体混合物中回收I2
C.用图2所示装置蒸干FeSO4饱和溶液来制备FeSO4•7H2O
D.用图3所示装置除去Cl2中含有的少量HCl
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.CH2=CH2与CH3CH2OH均可以使KMnO4(H+)褪色,且褪色原理相同
B.乙酸乙酯的制取中,水浴加热的目的有:加快化学反应速率,同时使产物分离,平衡正向移动
C.等物质量的CH3CH2OH与CH3COOH,均能与足量的金属钠发生取代反应,前者反应速率较后者慢,且生成等物质量的H2
D.在一溴乙烷中加入NaOH和CH3CH2OH,加热,加入HNO3酸化的AgNO3,出现淡黄色沉淀,说明溴乙烷发生了水解反应
难度: 中等查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是
A.X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性
B.Y、W的氢化物的稳定性后者强于前者
C.X、Y、Z、W形成的简单离子半径大小依次增大
D.Z的单质可与X、Y形成的共价化合物反应生成X2单质
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中一定能大量共存的是
A.加入铝粉产生H2 的溶液中: Fe2+、Na+、SO42-、ClO-
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C.c(H+)/c(OH-)=1012 的溶液中:NH4+、Al3+、NO3-、Cl-
D.使甲基橙呈红色的溶液:K+、Cl-、SO42-、S2O32-
难度: 困难查看答案及解析
-
25℃时,用浓度为0.1000 mol·L-1的NaOH溶液滴定20.00 mL浓度均为0.1000 mol·L-1的三种酸HX、HY、HZ滴定曲线如图所示。下列说法正确的是

A.在相同温度下,同浓度的三种酸溶液的酸性强弱顺序:HZ<HY<HX
B.HZ、HY、HX均为弱酸
C.向HY溶液中加入10.00mLNaOH溶液,一定有c(Y-)+c(OH-)=c(H+)+ c(Na+)
D.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:
c(X-)>c(Y-)>c(OH-)>c(H+)
难度: 困难查看答案及解析