-
(12分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+ 8NH3 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
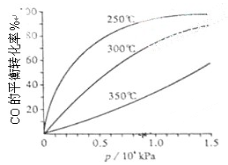
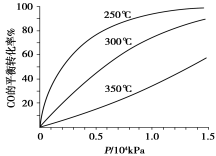
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
-
今年我国多个城市遭雾霾天气,这表明污染严重,空气质量下降。因此研究NO2、SO2、CO等大气污染气体的处理具有重要现实意义。
(1)NO2可用水吸收,相应的化学反应方程式为 。
(2)利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
(3)硝酸工业尾气中含NO和NO2气体,常用NaOH溶液来吸收,反应方程式为NO+NO2+2NaOH====2NaNO2+H2O,该反应中氧化剂和还原剂的物质的量之比是 。
(4)SO2是形成酸雨的主要物质,可以用氨水吸收消除污染,写出过量氨水与SO2反应的离子方程式 。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。利用反应6NO2+ 
 7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N5+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
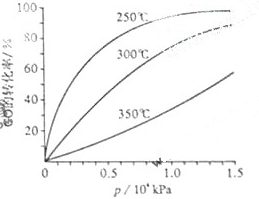
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
-
(7分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
① 写出NO2氧化SO2的热化学方程式
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
③测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
(3)CO可用于合成甲醇,反应方程式为
CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。
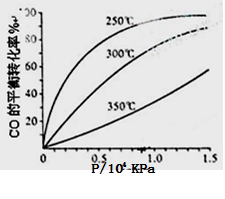
该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择
此压强的理由是。
-
(10分)研究NO2、SO2 、等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。利用反应6NO2+ 8NH3  7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L 。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L 。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH = - 196.6 kJ· mol-1
2SO3(g) ΔH = - 196.6 kJ· mol-1
2NO(g)+O2(g) 2NO2(g) ΔH = - 113.0 kJ· mol-1
2NO2(g) ΔH = - 113.0 kJ· mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH =kJ· mol-1。
SO3(g)+NO(g)的ΔH =kJ· mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K=________。
-
研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为___。利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
7N2+12H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是___L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g)
2SO3(g) ΔH=-196.6kJ/mol;2NO(g)+O2(g) 2NO2(g) ΔH=-113.0kJ/mol;
2NO2(g) ΔH=-113.0kJ/mol;
①则反应NO2(g)+SO2(g) SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
SO3(g)+NO(g) ΔH的ΔH=___kJ/mol。
②一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___。
A.体系压强保持不变
B.混合气体颜色保持不变
C.SO3和NO的体积比保持不变
D.每消耗1molSO3的同时生成1molNO2
③测得上述反应平衡时NO2与SO2的体积比为1:6,则平衡常数K=___。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
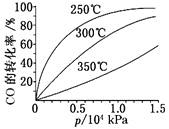
该反应ΔH___0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是___。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是________L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol
2NO2(g) ΔH=-113.0 kJ·mol
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=________kJ·mol-1。
SO3(g)+NO(g)的ΔH=________kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变 d.每消耗1 mol SO3的同时生成1 molNO2
该温度下,此反应的平衡常数表达式K=________。
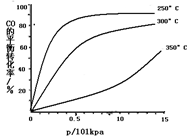
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________。
-
(14分)研究NOx、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为________。
利用反应6NO2+8NH3 7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
7N2+12H2O也可处理NO2。当转移0.4mol电子时,消耗的NO2在标准状况下的体积是______L。
(2)SO2可用足量的NaOH溶液吸收,该反应的离子方程式为______;若继续通入SO2,当n (SO2): n(NaOH)=1:1时所得溶液呈酸性,下列关系正确的是_____ (填字母编号)。
a. c(Na+)> c(HSO3 -)> c(SO32-)
b. c(Na+)+ c(H+)= c(SO32-)+ c(HSO3 -)+ c(OH-)
c. c(Na+)= c(SO32-)+ c(HSO3 -)
SO2也可用O2氧化生成SO3
已知:①NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH = -41.8 kJ/mol ;
SO3(g)+NO(g) ΔH = -41.8 kJ/mol ;
②2NO(g)+O2(g)  2NO2(g) ΔH = -113.0 kJ/mol ;
2NO2(g) ΔH = -113.0 kJ/mol ;
则反应2SO2(g)+O2(g)  2SO3(g) ΔH=______ kJ/mol。
2SO3(g) ΔH=______ kJ/mol。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g),CO在不同温度下的平衡转化率与压强的关系如图所示。
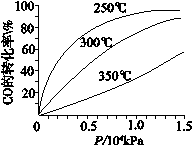
①该反应ΔH______0(填“>”或“<”)。
②若容器容积不变,下列措施可提高CO转化率的是_____。
a.升高温度 b.将CH3OH(g)从体系中分离
c.充入氦气,使体系总压强增大 d.再充入一定量的 CO气体
-
(7分) 研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)这三种氧化物中,属于酸性氧化物的是____________(用化学式表示)。
(2)NO2可用水吸收,相应的化学反应方程式为 。利用反应6NO2+8NH  7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(3)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1= - 196.6 kJ·mol-1
2SO3(g) ΔH1= - 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2= - 113.0 kJ·mol-1
2NO2(g) ΔH2= - 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
SO3(g)+NO(g)的 ΔH3= kJ·mol-1。
-
研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为______________________。利用反应6NO2+8NH3  7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰6,则平衡常数K=__________________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
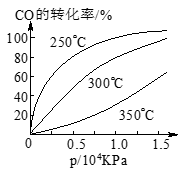
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH___________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________________。
2SO3(g) ΔH=-196.6 kJ·mol—1,2NO(g)+O2(g)
2NO2(g) ΔH=-113.0 kJ·mol—1,则反应:NO2(g)+SO2(g)
SO3(g)+NO(g)的ΔH= kJ·mol—1
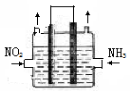
7N2+12H2O可处理NO2。一定条件下,将该反应设计成如右图所示装置,其中电极均为石墨,使用熔融金属氧化物作电解质,写出负极电极反应式 ;若一段时间内测得外电路中有1.2mol电子通过,则两极共产生的气体产物在标准状况下的体积为 L。
SO3(g)+NO(g),下列能说明该反应达到平衡状态的是 。
CH3OH(g)。一定温度下,向容积为2L的密闭容器中充入2molCO和2molH2发生上述
反应,5min后反应平衡,此时测得CH3OH的浓度为0.3mol/L,计算反应开始至平衡时的平均速率v(H2)= ;该温度下反应的平衡常数为 (保留两位小数)。

 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是




