-
BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。

已知:室温时Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_____________________________________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是_______________;沉淀A的主要成分是_______________。
(3)热空气吹除时会有部分HS-转变为S2O O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为______________________________________________________。
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是__________,另一离子浓度为______mol/L (当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象________,发生反应的离子方程式___________________。
(5)将足量的SO2气体通入BaCl2溶液中有无明显现象_____________(填“有”或“无”),向NaOH溶液中通入足量的SO2气体,写出所得溶液离子浓度的大小顺序________________。
-
BaCl2•xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2•xH2O,工艺流程如下图所示。

已知:室温时Ksp[Mg(OH)2]= 1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38,请回答下列问题:
(1)写出氯化钡的电子式______,盐酸和硫化钡反应的化学方程式为___________。
(2)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为_______________________。
(3)沉淀A的成分是__________。
(4)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________________。
(5)室温时,若加碱调溶液pH至9,则完全沉淀的离子是_____________(写出计算过程)。
-
BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:

已知:室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32-,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
-
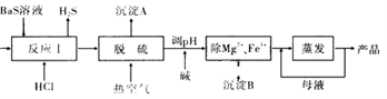
(14分)BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如图所示。请回答:
已知:室温时Ksp[Mg(OH)2 ]=1.8×10-11 ,Ksp[Fe(OH)3 ]=4.0×10-38
(1)反应I中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通人空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓人预热后的空气吹出,预热空气的目的是_________;沉淀A的主要成分是_________。
(3)热空气吹除时会有部分HS-转变为S2O32 -,使产品仍不能达到纯度要求,可再行酸化脱硫,酸化脱硫时的离子方程式为_________。
(4)室温时,为使Mg2+、Fe3+完全沉淀(当溶液中离子浓度小于1×l0-5mol 时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
时认为该离子完全沉淀),应将溶液的pH调至_________(只列算式)以上。
(5)实验室测定产品中x的步骤如下:
①准确称取12.23 g BaCl2·xH2O样品,加入l00 mL稀盐酸加热溶解;
②边搅拌,边逐滴加入0.lmol H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
H2SO4溶液,待BaSO4完全沉淀,过滤,沉降后洗涤沉淀2—3次;
③将沉淀充分干燥后称量,质量为11.65 g,检验BaSO4沉淀是否洗涤干净的方法是_______;经计算x的数值为_________。
-
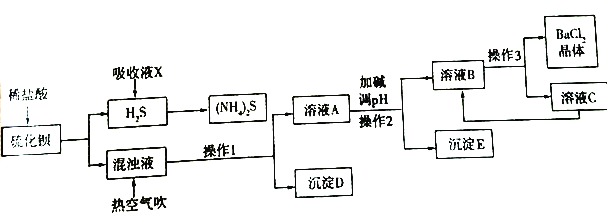
BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
已知: 室温时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]= 4.0×10-38
请回答下列问题:
(1)写出氯化钡的电子式________。盐酸和硫化钡反应的化学方程式为________。
(2)吸收液X的溶质是________。一定条件下向(NH4)2S溶液中通入空气,可得到单质硫并使吸收液再生,吸收液再生反应的化学方程式为________。
(3)操作1的名称是________,操作3 的过程是将容液B 蒸发浓缩、________、过滤等。
(4)沉淀D 的成分是________。
(5)热空气吹除时会有部分HS-转变为S2O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为________。
(6)室温时,若加碱调溶液pH 至9,则完全沉淀的离子是________ 。
(7)此工艺流程中循环利用的物质是________。
-
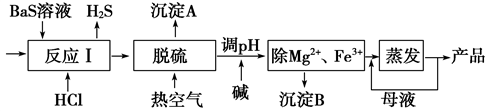
BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
已知:室温时Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为______________________________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是_______________;沉淀A的主要成分是_______________。
(3)热空气吹除时会有部分HS-转变为S2O ,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为____________________________________________。
,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为____________________________________________。
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是__________,另一离子浓度为______mol/L (当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象________,发生反应的离子方程式___________________。
-
硼氢化钠(NaBH4)广泛用于化工生产,常温下能与水反应,易溶于异丙胺(沸点为33 ℃)。工业上可用硼镁矿(主要成分为Mg2B2O5·H2O,含少量杂质Fe3O4)制取NaBH4,其工艺流程如下:

回答下列问题:
(1)NaBH4中氢元素的化合价为_______。
(2)碱溶时Mg2B2O5发生反应的化学方程式是________。
(3)滤渣的主要成分是_____。
(4)高温合成中,加料之前需将反应器加热至100 ℃以上,并通入氩气。通入氩气的目的是_____。
(5)操作2的名称为______,流程中可循环利用的物质是_____。
(6)在碱性条件下,用惰性电极电解NaBO2溶液也可制得NaBH4,装置如图所示,电解总反应的离子方程式为_______。

(7)NaBH4常用作还原剂,H2也是常见的还原剂。与相同氧化剂反应时,1 g NaBH4的还原能力相当于_____g H2的还原能力(结果保留两位小数)。
-
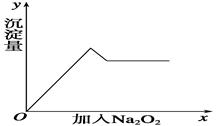
(4分)有一无色透明溶液,可能含Cu2+、NH、Al3+、Fe3+、Mg2+、Na+、K+、CO、SO、NO等离子中的若干种。现做如下实验:
①取少量该溶液,滴入用盐酸酸化的BaCl2溶液,有白色沉淀生成。
②另取部分溶液,加入过氧化钠,有无色气体放出,且有白色沉淀产生,加入过氧化钠的量与生成白色沉淀的量可用右图表示。
试推断:
(1)该溶液中一定存在__________________,一定不存在____________________,可能存在______________。
(2)上述溶液中至少有______________________等物质混合而成。
-
市售氯化钾中所含杂质以Na+和Mg2+为主,也含有少量S 、Fe3+等。提纯过程如下:
、Fe3+等。提纯过程如下:

(1)操作Ⅰ所用的玻璃仪器有 ;操作Ⅱ的主要步骤是 。
(2)滤渣b的主要成分是 。
(3)检验BaCl2溶液是否加入过量,其详细操作过程为
。
(4)产品KCl晶体可能仍含少量的NaCl,检验的方法是 ,进一步提纯的方法是 。
(已知NaCl溶解度受温度影响较小)
-
以粗盐(主要成分为NaCl,含少量Ca2+、Mg2+、Fe3+、SO
 等)为原料制备亚氯酸钠(NaClO2)的工艺如下(试剂A为依次加入的过量BaCl2、NaOH、Na2CO3溶液):
等)为原料制备亚氯酸钠(NaClO2)的工艺如下(试剂A为依次加入的过量BaCl2、NaOH、Na2CO3溶液):
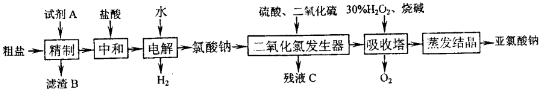
回答下列问题:
(1)“精制”过程中,加入过量的Na2CO3的作用是______.
(2)电解时发生主要反应的离子方程式为______ ClO3-+3H2↑










