-
每年的3月22日为世界水日,旨在唤起公众的水意识,加强水资源保护。下列不是水质检测指标的是
A.PM2.5 B.pH C.溶解氧 D. 细菌数
难度: 简单查看答案及解析
-
目前人类正在研究发展从海底开采可燃冰(CH4•nH2O)的技术,以解决能源问题。下列有关说法错误的是
A.可燃冰是分子晶体,熔沸点低
B.CH4分子结构是对称的
C.H2O是非极性分子
D.使用可燃冰替代煤和石油,可以解决酸雨问题
难度: 中等查看答案及解析
-
常温下,溴单质不可能发生的反应类型是
A.化合 B.复分解 C.加成 D.取代
难度: 中等查看答案及解析
-
有关碳元素及其化合物的化学用语正确的是
A.CO2的电子式:
B.C原子最外层电子的轨道表示式:
C.醋酸钠的分子式:C2H3O2Na
D.乙烯的比例模型:

难度: 中等查看答案及解析
-
下列物质的水溶液因发生水解而显酸性的是
A.NaHSO4 B.KCl C.NH4Cl D.H2SO4
难度: 中等查看答案及解析
-
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确的是
A.硫化氢很稳定,受热难分解
B.将硫化氢通入氯水中,氯水褪色并产生浑浊
C.硫化氢在足量氧气中燃烧生成淡黄色固体
D.硫化氢是弱电解质,其电离方程式是H2S ⇋ 2H+ + S2-
难度: 中等查看答案及解析
-
有关化学键和晶体的说法中正确的是
A.离子键的本质是静电作用,因此只能存在于由阴、阳离子构成的物质中
B.共价键的本质是共用电子对,因此必须由成键的两原子各提供一个电子形成
C.分子晶体的基本微粒是分子,因此分子晶体中只存在分子间作用力
D.原子晶体由于是空间网状结构,因此只能由碳、硅两元素构成
难度: 中等查看答案及解析
-
下列物质的工业生产过程中,其主要反应不涉及氧化还原反应的是
A.纯碱 B.烧碱 C.硫酸 D.硝酸
难度: 中等查看答案及解析
-
下图是制取和收集某气体的实验装置,该装置可用于

A.用浓硫酸和氯化钠反应制取HCl
B.用浓氨水和生石灰反应制取NH3
C.用双氧水与二氧化锰反应制取O2
D.用饱和食盐水和电石反应制取C2H2
难度: 中等查看答案及解析
-
五颜六色的变化增添了化学的魅力。下列有关反应的颜色变化叙述:①新制氯水久置后→无色;②淀粉溶液遇单质碘→蓝色;③溴化银见光分解→银白色;④热的氧化铜遇乙醇→红色;⑤硝酸银溶液和碘化钾溶液产生沉淀→黄色;⑥苯酚在空气中被氧化→粉红色。其中正确的是
A.①②④⑤⑥ B.②③④⑤⑥ C.①②③④⑤ D.①④⑤⑥
难度: 中等查看答案及解析
-
有关下图装置的说法中正确的是
A.若两电极直接连接,a是食盐水,则发生析氢腐蚀
B.若两电极直接连接,则负极反应一定是:Fe-2e→Fe2+
C.若铁接电源负极,石墨接电源正极,a是食盐水,左侧电极上析出的气泡比右侧电极上的多
D.若铁接电源负极,石墨接电源正极,a是氯化铜,铁上有气泡
难度: 中等查看答案及解析
-
硫单质有两种常见的同素异形体:单斜硫和正交硫。已知常温常压下:
① S (s,单斜)+O2 (g)→SO2 (g)+297.16kJ;
② S (s,正交)+O2 (g)→SO2 (g)+296.83kJ
下列说法正确的是
A.常温常压下单斜硫比正交硫稳定
B.单斜硫转变为正交硫的能量变化可用下图表示
C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ
D.反应①中生成1 L SO2 (g)放出297.16kJ热量
难度: 中等查看答案及解析
-
有机物的除杂方法中正确的是(括号中的是杂质)
A.乙酸(乙醛):加入新制的氢氧化铜,加热
B.苯(苯酚):加入溴水,过滤
C.溴乙烷(溴单质):加入热氢氧化钠溶液洗涤,分液
D.乙酸乙酯(乙酸):加入饱和碳酸钠溶液洗涤,分液
难度: 中等查看答案及解析
-
天然蛋白质水解的最终产物是α-氨基酸,结构如图所示,下列有关α-氨基酸的说法中错误的是
A.α-氨基酸既能与酸反应,又能与碱反应
B.α-氨基酸在酸溶液中主要以阳离子形式存在
C.α-氨基酸在碱溶液中主要以阴离子形式存在
D.α-氨基酸难溶于水
难度: 中等查看答案及解析
-
一定温度下,水存在H2O ⇋ H+ + OH- + Q(Q<0)的平衡,下列叙述一定正确的是
A.向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B.将水加热,Kw增大,pH减小
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.向水中加入少量固体硫酸钠,c(H+)=10-7mol/L,Kw不变
难度: 中等查看答案及解析
-
含有下列各组离子的溶液中,滴入过量溴水后仍能大量共存的是
A.Na+、Fe2+、SO42-、Cl―
B.Ag+、Al3+、H+、NO3―
C.Na+、K+、SO42-、SO32-
D.NH4+、Ca2+、NO3―、Cl-
难度: 中等查看答案及解析
-
将a g铝粉加入过量NaOH溶液中充分反应后,铝粉完全溶解,并收集到标准状况下b L氢气,所得溶液中共有c个溶质离子,反应中转移电子d个。则阿伏加德罗常数(NA)可表示为
A.
B.
C.
D.
难度: 中等查看答案及解析
-
向Na2CO3溶液中逐滴加入水杨酸(
)溶液,可能发生的反应的离子方程式且书写正确的是
A.
+CO32―→
+HCO3―
B.
+CO32―→
+HCO3―
C.2
+CO32―→2
+CO2↑
D.3
+2CO32―→3
+HCO3―+H2O+CO2↑
难度: 中等查看答案及解析
-
如图是部分短周期元素化合价与原子序数的关系,下列说法正确的是

A.最高价氧化物对应水化物酸性: Y>W>T
B.气态氢化物的稳定性:Y>W
C.单质氧化性:W>X
D.离子半径: W>X>Z>T
难度: 中等查看答案及解析
-
用下列实验装置进行的实验中,能达到相应实验目的的是
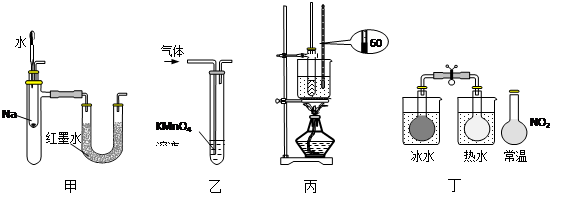
A.装置甲:验证Na和水反应放热
B.装置乙:除去乙烯中混有的乙炔
C.装置丙:用于实验室制硝基苯
D.装置丁:说明反应2NO2(g) ⇋ N2O4(g)是放热反应
难度: 中等查看答案及解析
-
常温下a mol/L 稀氨水和b mol/L 稀盐酸等体积混合,对混合后溶液判断一定正确的是
A.若a=b,则c(NH4+)=c(Cl―) B.若a>b,则c(NH4+)>c(Cl―)
C.若a>b,则c(OH-)>c(H+) D.若a<b,则c(OH-)<c(H+)
难度: 中等查看答案及解析
-
将10.92 g锌铁合金粉末加入含0.4 mol H+的稀硝酸和稀硫酸的混合溶液中,充分反应后收集得到的气体体积(标准状况下)可能为(假设气体全部逸出,稀硝酸的还原产物是NO)
A.2.4 L B.3.6 L C.4.8 L D.6.0 L
难度: 中等查看答案及解析