-
化学与生活、社会密切相关。下列说法不正确的是( )
A.光导纤维导电能力很强,是一种很好的通讯材料
B.纯碱不仅有较强的去油污能力,还可以用于中和发酵面团中的酸性物质
C.煤的气化和液化都属于化学变化
D.钛被誉为“太空金属”,室温下不与水、稀硫酸、稀硝酸反应,却溶于氢氟酸,可能是因为氟离子易与钛离子形成可溶性难电离物质
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.过氧化钠的电子式:
B.质子数为35、中子数为45的溴原子:
Br
C.硫离子的结构示意图:
D.间二甲苯的结构简式:
难度: 中等查看答案及解析
-
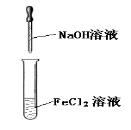
下列实验能达到目的的是( )


用酒精萃取溴水中的溴
将硫酸铜溶液直接蒸干得到胆矾
说明2NO2(g)
N2O4(g) △H<0
实验室制备Fe(OH)2
A
B
C
D
难度: 中等查看答案及解析
-
下列说法或表述正确的是( )
①过氧化钠中阳离子和阴离子个数比为1:1
②纯碱既属于正盐又属于钠盐和碳酸盐。
③相同温度下,氢氧化钠溶液的导电能力比氨水溶液强
④丁达尔效应可用于区别溶液和胶体,烟、云、雾均为胶体,能产生丁达尔效应。
⑤钢铁的吸氧腐蚀,负极发生反应:Fe-2e-=Fe2+
A .①②④⑤ B.②③④ C.②④⑤ D.③④⑤
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y 的次外层电子数是最外层的
,ZX2是一种储氢材料,W与Y属于同一主族,下列叙述正确的是( )。
A.原子半径:rW>rZ>rY
B.Y形成的离子与W形成的离子的电子数不可能相同
C.化合物X2Y、ZY、WY3 中化学键的类型相同
D.由X、Y、Z、W组成的化合物的水溶液可能显酸性
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )。
A.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
B.将少量SO2通入苯酚钠溶液中:2C6H5O-+SO2+H2O=2C6H5OH+
C.用硫氰化钾溶液可以检验溶液中的Fe3+:Fe3++3SCN-=Fe(SCN)3↓
D.向碘化亚铁溶液中通入过量的氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
难度: 中等查看答案及解析
-
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3
K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是( )
A.生成40.0LN2(标准状况) B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol D.被氧化的N原子的物质的量为3.5mol
难度: 中等查看答案及解析
-
类比推理的方法在化学学习与研究中有广泛的应用,但有时会得出错误的结论。以下几种类比推理结论中正确的是( )
A.H2SO4为强酸,推出HClO4为强酸
B.Fe3Cl8可以改写为FeCl2·2FeCl3,推出Fe3I8可以改写为FeI2·2FeI3
C.NH3的沸点高于PH3,推出CH4沸点高于SiH4
D.CO2通入Ba(NO3)2溶液中无沉淀生成,推出SO2通入Ba(NO3)2溶液中无沉淀生成
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
B.2NO(g)+2CO(g)===N2(g)+2CO2(g)在常温下能自发进行,则该反应的ΔH>0
C.加热0.1 mol·L-1Na2CO3溶液,CO
的水解程度和溶液的pH均增大
D.对于乙酸与乙醇的酯化反应(ΔH<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大
难度: 中等查看答案及解析
-
已知AgCl、AgBr的溶解度分别为1.5×10-4g、8.4×10-6 g(20℃)。将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓硝酸银溶液,发生的反应为( )。
A.只有AgBr沉淀生成 B. AgCl和AgBr沉淀等量生成
C. AgCl沉淀少于AgBr沉淀 D. AgCl沉淀多于AgBr沉淀
难度: 中等查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
B.等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C.pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
难度: 中等查看答案及解析
-
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L(标准状况)氧气,从而可知M的相对原子质量是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为 KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2
有关该电池的说法正确的是( )
A.充电过程是化学能转化为电能的过程
B.放电时电解质溶液中的OH-向正极移动
C.充电时阳极反应:Ni(OH)2 -e— + OH- == NiOOH + H2O
D.放电时负极附近溶液的碱性不变
难度: 中等查看答案及解析
-
已知NO2与N2O4相互转化:2NO2(g)
N2O4(g);△H=-24.4kJ/mol在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的量浓度随时间变化的关系如下图。下列推理分析合理的是( )
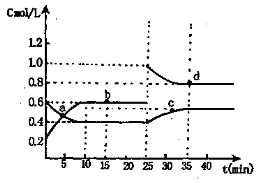
A.前10min内,用v(NO2)表示的该反应速率为0.02mol/(L·min)
B.反应进行到10min时,体系吸收的热量为9.76kJ
C.a,b,c,d四点中v正与v逆均相等
D.25min时,导致平衡移动的原因是升温
难度: 中等查看答案及解析
-
某碳、氢、氧有机物的蒸气密度是CO2的2倍(相同条件),它含有“
”的且只含一个官能团的同分异构体有( )。
A.4种 B.5种 C.6种 D.8种
难度: 中等查看答案及解析
-
向一洁净干燥的烧杯中加入44.4gAl粉与Fe粉混合物,然后加入过量的盐酸,产生标况下气体26.88L。若将该混合物加入500mL14 mol·L-1的HNO3中(不考虑发生钝化),产生的气体(标准状况下测定)如图所示,假设HNO3的还原产物为NO与NO2,那么理论上从哪一时刻开始产生NO气体?(假设浓度小于9mol/L为稀HNO3)( )
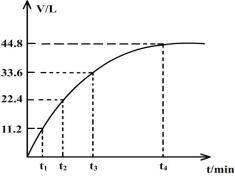
A. t1 B.t2 C.t3 D.t4
难度: 中等查看答案及解析