-
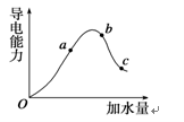
常温下,将pH=3的盐酸a L分别与下列三种溶液混合后,混合液均呈中性:
①1×10-3 mol·L-1的氨水b L
②c(OH-)=1×10-3 mol·L-1的氨水c L
③c(OH-)=1×10-3 mol·L-1的Ba(OH)2溶液d
其中a、b、c、d的关系正确的是( )
A.a=b>c>d B.b>a=d>c C.a=b>d>c D.c>a=d>b
难度: 中等查看答案及解析
-
下列按纯净物、混合物、电解质和非电解质顺序排列的是( )
A. 盐酸、空气、醋酸、干冰 B. 冰醋酸、碱石灰、硫酸钠、乙醇
C. 蛋白质、油脂、苛性钠、石灰石 D. 胆矾、漂白粉、氯化钾、硫酸钡
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.光照新制的氯水时,溶液的pH逐渐减小
B.氨水应密闭保存于低温处
C.打开汽水瓶时,有大量气泡逸出
D.高温高压有利于N2和H2转化为NH3:N2(g)+3H2(g)
2NH3(g) ΔH<0
难度: 中等查看答案及解析
-
下列各关系式中能说明反应N2+3H2
2NH3已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
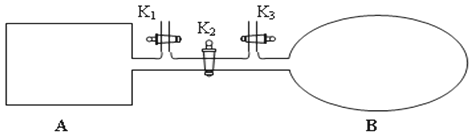
利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
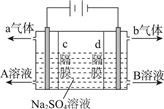
A. a气体为氢气,b气体为氧气
B. A为氢氧化钠溶液,B为硫酸溶液
C. 通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D. 该电解反应的方程式为2Na2SO4+6H2O
2H2SO4+4NaOH+O2↑+2H2↑
难度: 困难查看答案及解析
-
有关下列四个常用电化学装置的叙述中,正确的为
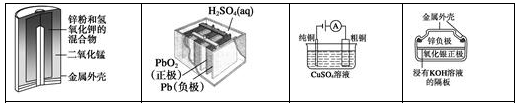
A.图Ⅰ所示电池中,MnO2的作用是催化剂
B.图II所示电池放电过程中,硫酸浓度不断增大
C.图III所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图IV所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
难度: 中等查看答案及解析
-
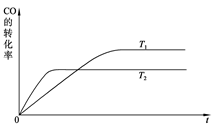
已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A.CO的燃烧热为283 kJ
B.如图可表示由CO生成CO2的反应
过程和能量关系
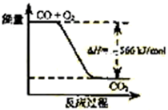
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)
H2(g)+I2(g)。若c(HI)由0.1 mol·L-1降到0.07 mol·L-1时,需要15 s,那么c(HI)由0.07mol·L-1降到0.05 mol·L-1时,所需反应的时间为( )
A.等于Ss B.等于10 s C.大于10 s D.小于10 s
难度: 中等查看答案及解析
-
在一密闭容器中进行反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.2 mol·L-1。当反应达到平衡时,可能存在的数据是( )
A. SO2为0.4 mol·L-1,O2为0.2 mol·L-1 B. SO2为0.2 mol·L-1
C. SO2、SO3分别为0.15 mol·L-1 、 0.3 mol·L-1 D. SO3为0.4 mol·L-1
难度: 中等查看答案及解析
-
如图所示,一定条件下将lmolA气体和3molB气体充入一个体积可变的密闭容器中,可滑动活塞的位置图1所示。在恒温恒压下发生A(g)+3B(g)
2C(g),当反应达到平衡时,活塞位置如图2所示,则平衡时A的转化率为( )
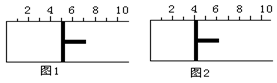
A.20% B.40% C.50% D.无法确定
难度: 中等查看答案及解析
-
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)
2C(g),达到平衡后,只改变反应的一个条件,测得容器中各物质的浓度、反应速率随时间变化的关系如图所示。下列说法正确的是( )
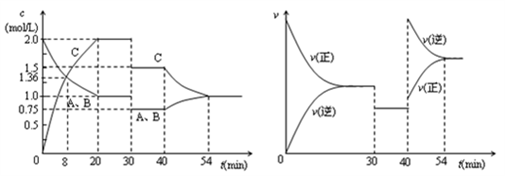
A. 前20min B的平均反应速率为0.05mol·L-1·min-1
B. 8 min时表示正反应速率等于逆反应速率
C. 反应方程式中的x=1,30 min时表示增大压强
D. 40 min时改变的条件是升高温度,且正反应为吸热反应
难度: 中等查看答案及解析
-
某固定体积的密闭容器中,加入一定量的A达化学平衡:aA(g)
bB(g)+cC(g),在温度不变的条件下,再充入一定量的A,重新达到平衡时,下列判断中正确的是( )
A.若a=b+c时,B的物质的量分数变大
B.若a=b+c时,B的物质的量分数不变
C.若a>b+c时,A的转化率不变
D.若a<b+c时,A的转化率变大
难度: 中等查看答案及解析
-
某温度下反应N2O4(g)
2NO2(g)(正反应为吸热反应),在密闭容器中达到平衡,下列说法正确的是( )
①加压时(体积变小),将使正反应速率增大②保持体积不变,加入少许NO2,将使正反应速率减小;③保持体积不变,加入少许N2O4,再达到平衡时颜色变深;④保持体积不变,升高温度,再达平衡时颜色变深 ⑤升高温度,正反应速率减小,平衡逆向移动
A. ①④⑤ B. ③④⑤ C. ①③④ D. ①②③④⑤
难度: 中等查看答案及解析
-
关于常温下pH=2的醋酸,下列叙述正确的是
A.c(CH3COOH)=0.01mol·L-1
B.c(H+)=c(CH3COO-)
C.加水稀释100倍后,溶
液pH=4
D.加入CH3COONa固体,可抑制CH3COOH的电离
难度: 简单查看答案及解析
-
如图是温度和压强对反应X+Y
2Z影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
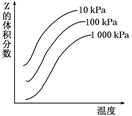
A. 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据
B. X、Y、Z均为气态
C. 上述反应的逆反应的△H>0
D. 使用催化剂Z的产率提高
难度: 中等查看答案及解析
-
有四种物质的量浓度相等且都由一价阳离子A+和B+及一价阴离子X-和Y-组成的盐溶液。据测定常温下AX和BY溶液的pH=7,AY溶液的pH>7,BX溶液的pH<7,由此判断不水解的盐是( )
A. BX B. AY C. AX D. BY
难度: 中等查看答案及解析
-
表是25℃时某些弱酸的电离平衡常数,下列说法正确的是( )
化学式
CH3COOH
HClO
H2CO3
Ka
1.8×10﹣5
3.0×10﹣8
Ka1=4.1×10﹣7Ka2=5.6×10﹣11
A. 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:
c(Na+)>c(ClO﹣)>c(CH3COO﹣)>c(OH﹣)>c(H+)
B. 向0.1mol·L﹣1CH3COOH溶液中滴加NaOH溶液至溶液pH=5,此时:
c(CH3COOH):c(CH3COO﹣)=9:5
C. 少量碳酸氢钠固体加入到新制的氯水中,c(HClO)增大
D. 等体积等物质的量浓度的CH3COONa(aq)与NaClO(aq)中离子总数大小:N前<N后
难度: 困难查看答案及解析