-
化学与生产生活、环境密切相关,下列说法正确的是
A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量
B.工业废水可经过“再生”处理,用于城市道路保洁、喷泉和浇花用水
C.硅单质常作为制备光导纤维的主要材料
D. 淘米水中含有淀粉可以直接检测加碘盐中是否含有碘元素
难度: 简单查看答案及解析
-
下列叙述均正确且前后有因果关系的是
A.常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀
B.常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物
C.BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀
D.非金属性:Cl > S,酸性:HClO > H2SO4
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应A(g) ⇋ 2B(g) △H,若正反应的活化能为Ea kJ/mol,逆反应的活化能为Eb kJ/mol,则△H=-( Ea- Eb)kJ/mol
B.常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同
C.某温度氯化钠在水中的溶解度是20 g,该温度饱和氯化钠溶液的质量分数为20%
D.将浓度为0.1 mol/L HF溶液加水不断稀释过程中,电离平衡常数Ka(HF)保持不变,始终保持增大
难度: 简单查看答案及解析
-
下列图与对应的叙述相符的是
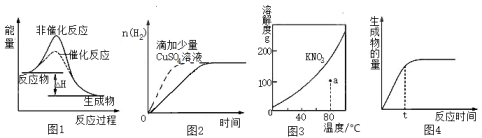
A.图1 表示某吸热反应分别在有、无催化剂时,反应过程中的能量变化
B.图2表示常温下,等量锌粉与足量、等浓度盐酸反应(滴加CuSO4溶液的为虚线)
C.图3表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
D.图4表示某可逆反应生成物的量随反应时间变化的曲线,t时反应物转化率最大
难度: 简单查看答案及解析
-
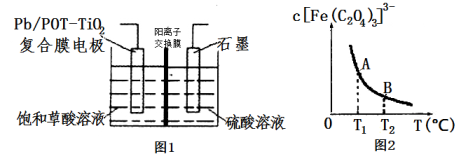
用右图装置研究电化学原理,下列分析中错误的是

难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g) △H=+QkJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(L·min)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应
难度: 中等查看答案及解析
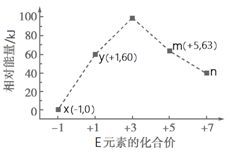
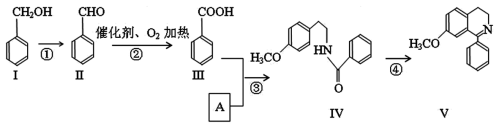
 写出满足上述条件的Ⅵ的结构简式
写出满足上述条件的Ⅵ的结构简式