-
化学与生活密切联系,下列与盐类水解无关的是
A.实验室配制FeCl3溶液时,应先将其溶解在盐酸中,而后加水稀释
B.实验室盛放Na2SiO3溶液的试剂瓶应用橡皮塞,而不能用玻璃塞
C.用NaHCO3粉末作灭火剂
D.加热蒸干A1C13溶液得到A1(OH)3固体
难度: 中等查看答案及解析
-
下列电池工作时,负极上有H2参与反应的是

难度: 中等查看答案及解析
-
下列各微粒中,能使水的电离平衡向电离方向移动.且使溶液的pH>7的是
A.
 B.OH- C.Fe3+ D.HCO3-
B.OH- C.Fe3+ D.HCO3-难度: 中等查看答案及解析
-
常温下,物质的量浓度均为0.1 mol/L的下列四种溶液,其中pH最小的是
A.CH3COONH4 B.Ba(OH)2 C.NH4A1(SO4)2 D.Na3PO4
难度: 中等查看答案及解析
-
只用NaOH溶液不能除去下列各组物质中的杂质(括号内为杂质)的是
A.Mg(Al2O3) B.MgCl2(A1Cl3) C.Mg(Si) D.MgO(SiO2)
难度: 中等查看答案及解析
-
物质溶于水的过程中通常伴随着能量的变化,下表为四种物质的溶解热(“+”表示吸热,“-”表示放热)。
化学式
NH4NO3
NaOH
Ba(NO3)2
KNO3
溶解热(kJ/mol)
+4.13
-26.01
+ 1.57
+3.49
将等物质的话的上述物质分别加入等质量的水中,所得溶液中水的离子积常数Kw最小的是
A.NH4NO3 B.NaOH C.KNO3 D.Ba(NO3)2
难度: 困难查看答案及解析
-
—定条件下,在恒容密闭容器中进行可逆反应:PCl5(g)
PCl3(g)+Cl2(g) △H>0,下列叙述不能说明反应已达到化学平衡状态的是
A. 容器压强保持不变
B. 混合气体的密度保持不变
C. 混合气体的平均相对分子质量不再改变
D. 相同时间内,生成1 mol PC15,同时生成1 mol PC13
难度: 中等查看答案及解析
-
下列陈述I、II均正确且有因果关系的是
选项
陈述I
陈述II
A
Na2O2具有漂白性
Na2O2可用于潜水呼吸用氧
B
SiO2有导电性
SiO2可用于制作光导纤维
C
浓H2SO4有脱水性
浓H2SO4可用于干燥Cl2、SO2
D
CO有还原性
CO可用来冶炼生铁
难度: 中等查看答案及解析
-
下列有机物的同分异构体(不含环状结构)数目为5的是
A.丙酸乙酯 B.C4H9C1 C.己酸 D.戊烯
难度: 中等查看答案及解析
-
下列实验装罝不能达到相应实验目的的是

难度: 中等查看答案及解析
-
25℃时,pH = 9的NaHA溶液中各微粒的物质的量浓度关系正确的是
A.c(A2-)>c(H2A) B.c(Na+)+c(H+) =c(OH-)+c(HA-)+2c(A2-)
C.c(Na+) =c( HA-) +c(H2A) D.c(H+) =c(A2-) +c(OH-)
难度: 中等查看答案及解析
-
已知:①CH4(g)+
O2(g)=CO(g)+2H2O(l) △H= -a kJ/mol
② 2C(s)+O2(g) =2CO(g) △H=-b kJ/mol
③ C(s)+CO2(g)=2CO(g) △H=+c kJ/mol
且a、b、c均大于0,则甲烷的燃烧热(△H)为
A.
B.
C.
D.
难度: 困难查看答案及解析
-
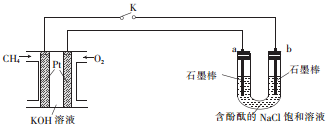
用NO2和NH3作原电池的燃料,能将氮氧化物转化为 N2,减轻环境污染,装置如图所示。下列说法正确的是

A.电子从A电极流出,发生氧化反应
B.电极B的电极反应式为:2NO2+8e-+8H+=N2+4H2O
C.一段时间后电极A附近的溶液pH增大
D.当消耗4.48 L (标准状况)NH3时,转移电子的物质的量为1.6 mol
难度: 困难查看答案及解析
-
将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I(s)
NH3(g)+HI(g);
②2HI(g)
H2 (g)+I2(g);
③2NH3(g)
N2(g)+3H2 (g)。
达到平衡时,c(H2) = 2 mol/L,c(N2)=0.5mol/L ,c(HI)=4mol/L,则平衡时 NH3的浓度为
A 0.5 mol • L-1 B.2 mol • L-1 C.4 mol • L-1 D.5 mol • L-1
难度: 中等查看答案及解析
-
常温下,向10 mL0.1mol/LHR溶液中逐滴滴入0.1mol/L的氨水,所得溶液pH 及导电能力与加入氨水体积的关系如图。下列说法不正确的是
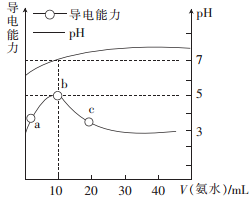
A. 常温下,电离平衡常数 Ka(HR)≈Kb(NH3 • H2O)
B. b点溶液pH=7,此时HR溶液与氨水恰好完全反应
C. c 点溶液中存在 c(NH4+ )>c(R- )>c(OH- )>c(H+)
D.a、b、c三点中,c点NH3 • H2O的电离程度最大
难度: 困难查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:断裂1 mol F—F键、S-F键需吸收的能量分别为160 kJ、330 kJ。在反应:S(s)+3F2(g)=SF6(g)中,若生成1 mol SF6(g)时, 放出1220 kJ的能量,则1 mol S(s)转化为S(g)时吸收的能量为
A.180 kJ B.220 kJ C.240 kJ D.280 kJ
难度: 中等查看答案及解析