-
2017年CCTV-3制作了一档文物节目《国家宝藏》,全面展示了很多非常有价值的文物。从化学角度看文物,下列对文物情况的化学解释错误的是
选项
文物
化学知识
A
乾隆年间“各种釉彩大瓶",其纹饰是用各种彩料绘制而成的
形成黄金色所用彩料的主要成分是氧化铁
B
北宋《千里江山图》颜料来自于矿物质,经研磨、溶解、过滤几道工序
这些工序涉及的是物理变化
C
春秋时期“越王勾践剑”经历两千多年依旧锋利,被称“千年不腐”
“千年不腐” 与其所处环境几乎无氧有关
D
“云梦睡虎地秦简”是在湖北出土的秦代竹筒。其中有记录保护
自然环境的案例日常生活中垃圾分类、电池回收等属于环保行为
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列说法不正确的是
A. 炒菜时,加一点酒和醋酸能使菜味香可口
B. 蔗糖在酸性条件下水解的产物互为同分异构体
C. CuSO4·5H2O可用于检验酒精中是否含有水
D. 利用油脂在碱性条件下的水解,可以制甘油和肥皂
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 0.1mol/LNaClO溶液中含有的Cl0-数为0.1NA
B. 一定条件下,2molSO2和ImolO2发生反应,转移的电子数为4NA
C. 1L0.1mol/L葡萄糖溶液中分子总数为0.1 NA
D. 60g石英晶体中含有的Si-O键数目为4 NA
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,其原子的最外层电子数之和为14,X 与Z同主族,Y 与W同主族,且X的原子半径小于Y。下列叙述正确的是
A. 简单离子半径:Y<Z
B. W 元素的氧化物对应的水化物可能是弱电解质
C. X2Y2 加入酸性高锰酸钾溶液中,还原产物为X2Y
D. X、Z都能分别与Y 形成含非极性键的分子
难度: 中等查看答案及解析
-
下表各组物质之间不能通过一步反应实现如图所示转化关系的是
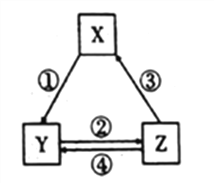
选项
X
Y
Z
对应箭头上所标数字的反应试剂
A
Fe
FeCl3
FeCl2
①④可用相同试剂
B
Al2O3
NaAlO2
Al(OH)3
②加氨水
C
NO
NO2
HNO3
②气体通入水中
D
Cl2
HClO
NaClO
③加浓盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,已知醋酸的电离常数Ka= 1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)= 3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c( H+)>c(OH-)
B. 将相同浓度的CH3COOH 溶液与CH3COO Na 溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg 沉淀生成
难度: 困难查看答案及解析
-
下列实验、现象及有关结论不正确的是
选项
A
B
C
D
实验

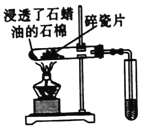


现象
加热铝箔,铝箔熔化却不滴落
石蜡油分解产生的气体能使试管中溴的四氯化碳溶液褪色
食盐水浸泡过的铁钉放入试管中,一段时间后,导管口形成一段水柱
向蔗糖中加人浓硫酸时,蔗糖变黑,体积膨胀
结论
氧化铝的熔点比铝的高
石蜡油的分解产物中含不饱和烃
铁钉发生吸氧腐蚀
浓硫酸具有吸水性和强氧化性
A. A B. B C. C D. D
难度: 中等查看答案及解析

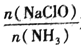 对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量) 的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。
对溶液中次氯酸钠去氨氮效果与余氯(溶液中+1价氯元素的含量) 的影响如图l4所示。a点之前溶液中发生的主要反应为_______(填序号)。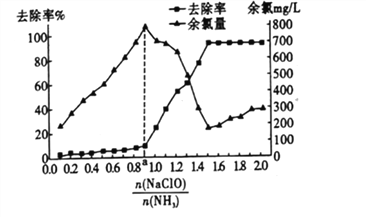
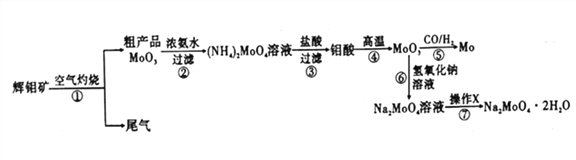
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。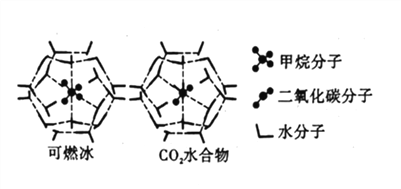

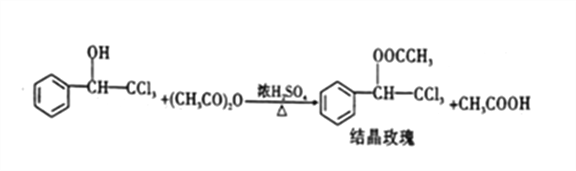
 ;
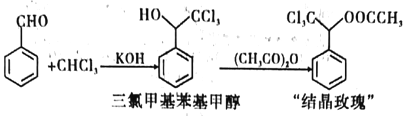
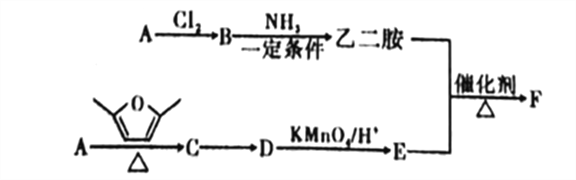
; 的合成路线:_____________________________。
的合成路线:_____________________________。