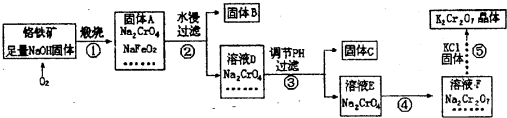
-
下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
( )元素代号 X Y Z W N 原子半径/nm 0.186 0.074 0.102 0.099 0.160 主要化合价 +1 -2 -2+6 +7-1 +2
A.W、N形成的化合物中含有极性键
B.常温下单质与水反应速率:X>N
C.最高价氧化物对应水化物酸性:W>Z
D.一种18电子的含Y的化合物属于共价化合物难度: 中等查看答案及解析
-
下列关于常见的有机物的说法中错误的是( )
A.甲烷、乙烯和苯都可以在空气中点燃
B.乙酸和乙酸乙酯都能与氢氧化钠溶液反应
C.塑料、橡胶和纤维素都是高分子化合物
D.乙醇、糖类和蛋白质都是人体必需的营养物质难度: 中等查看答案及解析
-
某粉末试样由几种常见氧化物组成.向该粉末试样中加入过量的氢氧化钠溶液,充分溶解后过滤得红棕色固体和无色溶液,向所得无色溶液中滴入盐酸,产生沉淀的质量与所加盐酸的体积的关系如图所示,组成该粉末试样的氧化物可能是( )
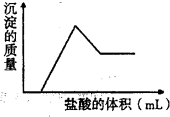
A.Fe2O3、MgO、Al2O3
B.Fe2O3、SiO2、Al2O3
C.CuO、SiO2、MgO
D.CuO、MgO、Al2O3难度: 中等查看答案及解析
-
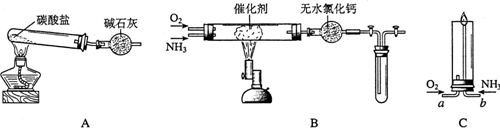
用图示装置进行A、B、C、D四组实验(如果需要可对圆底烧瓶加热),下列实验现象描述正确的是( )
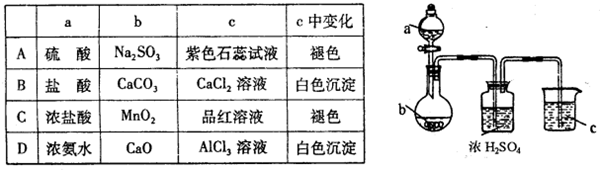
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
甲醇(CH3OH)燃料电池被认为是很有应用前景的燃料电池.下图是自呼吸式甲醇燃料电池工作示意图.电池总反应:2CH3OH+3O2=2CO2+4H2O,则图中进入c口的物质是( )
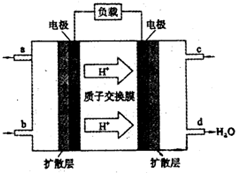
A.CH3OH
B.CO2
C.空气
D.H2O难度: 中等查看答案及解析
-
室温下,水的电离达到平衡:H2O
H++OH-,下列叙述正确的是( )
A.向水中加入少量NaOH固体,平衡向逆反应方向移动,c(OH-)降低
B.向水中加入少量盐酸,平衡向逆反应方向移动,c(H+)增大
C.向水中加入少量CH3COONa固体,平衡向正反应方向移动,KW增大
D.将水加热,平衡向正反应方向移动,KW不变难度: 中等查看答案及解析
-
在一定温度下,反应
H2(g)+
X2(g)⇌HX(g)的平衡常数为10.若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于( )
A.5%
B.17%
C.25%
D.33%难度: 中等查看答案及解析