-
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)==K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-1
已知:①碳的燃烧热△H1=akJ·mol-1
②S(s)+2K(s)==K2S(s) △H2=bkJ·mol-1
③2K(s)+N2(g)+3O2(g)==2KNO3(s) △H3=ckJ·mol-1 。则x为:
A. 3a+b-c B. c+3a-b C. a+b-c D. c+a-b
难度: 简单查看答案及解析
-
下列晶体熔化时不需要破坏化学键的是
A. 晶体硅 B. 食盐 C. 干冰 D. 金属钾
难度: 简单查看答案及解析
-
下列关于外围电子排布为3s23p4的粒子描述正确的是
A. 它的元素符号为O
B. 它的核外电子排布式为[Ar]3s23p4
C. 它在元素周期表中属于p区元素
D. 其电子排布图为:
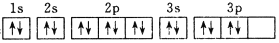
难度: 中等查看答案及解析
-
下列叙述中正确的是
A. CS2为V形的极性分子,形成分子晶体
B. CH3CH2OH分子中含有手性碳原子
C. 由于水分子间能形成氢键,所以H2O比H2S稳定
D. SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形
难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ/mol)。
I1
I2
I3
I4
……
R
740
1500
7700
10500
……
下列关于元素R的判断中一定正确的是
A. R的最高正价为+3价
B. R元素位于元素周期表中第ⅡA族
C. R元素的原子最外层共有4个电子
D. R元素基态原子的电子排布式为1s22s2
难度: 中等查看答案及解析
-
碳酸亚乙酯是锂离子电池低温电解液的重要添加剂,其结构如下图。下列有关该物质的说法正确的是
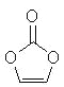
A.分子式为C3H2O3
B.分子中含6个σ键
C.分子中只有极性键
D.8.6g该物质完全燃烧得到6.72LCO2
难度: 中等查看答案及解析
-
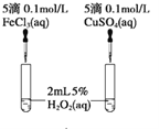
下列装置能达到对应实验目的的是
A. 比较MnO2和Fe2O3的催化效果
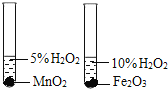
B. 测定中和热的大小
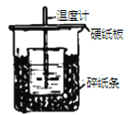
C. 验证Na与水反应为放热反应
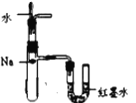
D. 定量测定反应速率大小

难度: 中等查看答案及解析
-
已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(L•s),则正确的关系是
A.
B.
C.
D.
难度: 中等查看答案及解析
-
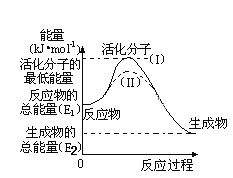
某反应过程中能量变化如图所示,下列说法正确的是

A. 反应过程a有催化剂参与
B. 因为生成物的总能量低于反应物的总能量,所以该反应不需要加热
C. 改变催化剂,可以改变该反应的活化能
D. 有催化剂条件下,反应的活化能等于E1+E2
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 常温常压下,1gH2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g) △H=+184.6kJ·mol-1
B. 甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知OH-(aq)+H+(aq)=H2O(l) △H=-57.3kJ·mol-1,则98%的浓硫酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量
D. 相同条件下,2mol氢原子所具有的能量大于1mol氢分子所具有的能量
难度: 中等查看答案及解析
-
已知CH3CH3→CH2=CH2+H2,有关化学键的键能如表所示。则该反应的反应热为
化学键
C-H
C=C
C-C
H-H
键能E/(kJ·mol-1)
414.4
615.3
347.4
435.3
A. +125.6kJ·mol-1 B. -125.6kJ·mol-1
C. +393.5kJ·mol-1 D. -393.5kJ·mol-1
难度: 中等查看答案及解析
-
下面的排序不正确的是
A. 晶体的熔点:
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法中正确的是
A. 28g晶体硅中含有Si—Si键的个数为2NA
B. 12g石墨晶体中含有C—C键的个数为3NA
C. 31g白磷中含有P—P键的个数为NA
D. SiO2晶体中1molSi可与O形成2NA个共价键(Si—O键)
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)==CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变能使反应速率加快的是
A. 增加C的量
B. 保持体积不变,充入N2使体系压强增大
C. 将容器的体积缩小一半
D. 保持压强不变,充入N2使容器体积增大
难度: 中等查看答案及解析
-
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如下图所示,对该反应的推断合理的是
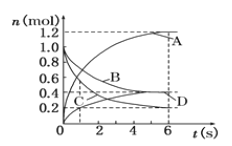
A. 该反应的化学方程式为3B+4D
6A+2C
B. 反应进行到1s时,v(A)=v(D)
C. 0~6s内,B的平均反应速率为0.05mol·L-1·s-1
D. 反应进行到6s时,B的转化率为40%
难度: 中等查看答案及解析
-
某学习小组为了探究BrO3-+5Br-+6H+
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号
离子浓度
①
②
③
④
⑤
c(H+)/mol·L-1
0.008
0.008
0.004
0.008
0.004
c(BrO3-)/mol·L-1
0.001
0.001
0.001
0.002
0.002
c(Br-)/mol·L-1
0.10
0.20
0.20
0.10
0.40
v/mol·L-1·s-1
2.4×10-8
4.8×0-8
1.2×10-8
4.8×10-8
v1
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
难度: 中等查看答案及解析