-
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 |
| 温度/℃ | 催化剂 |
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
试回答:实验1、2研究的是其他条件相同时________对H2O2分解速率的影响。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
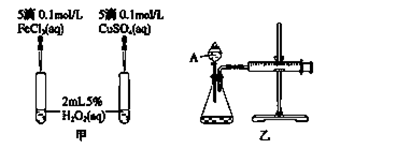
②定量分析:为了更精确地研究浓度对反应速率的影响,利用乙图装置进行定量实验。完成该实验应该测定的实验数据是____________________________________________ 。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
| 序号 | 条件 | 现象 | 结论 |
| 温度/℃ | 催化剂 |
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
试回答:
①实验1、2研究的是________对H2O2分解速率的影响。
②实验2、3的目的是________。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。
有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是__________________________。
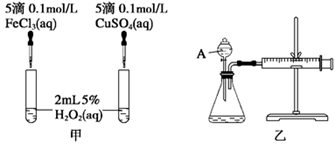
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是________。
(3)实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
-
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。
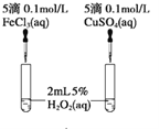
| 序号 | 条件 | 现象 | 结论 |
| 温度/℃ | 催化剂 |
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
(1)实验1、2的目的是研究__________因素对H2O2分解速率的影响。
(2)实验1对应的化学方程式为___________________________。
实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图所示的实验。可通过观察_________得出结论。 有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是____________________。
实验三:已知在高锰酸钾(KMnO4)酸性溶液和草酸(H2C2O4)溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显,但不久突然褪色,反应速率明显加快。
(1)写出硫酸酸化的高锰酸钾溶液和草酸溶液反应的化学方程式____________
(2)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是______。
(3)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
(4)若实验过程中将2.0mL0.10mol/LH2C2O4溶液与4.0mL0.010mol/L酸性KMnO4溶液混合(忽略溶液混合后体积的变化),测得溶液的褪色时间为40s,这段时间内平均反应速率v(KMnO4)=__________mol·L-1·min-1。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
①实验1、2研究的是________________对H2O2分解速率的影响。
②实验2、3的目的是_______________。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
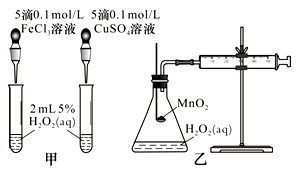
①定性分析:如图甲可通过观察________________,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_______________。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_____________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是 热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是____________________的影响。要证明你的猜想,实验方案是 。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
| 序号 | 温度/℃ | 催化剂 | 现象 | 结论 |
| 1 | 40 | FeCl3溶液 | | |
| 2 | 20 | FeCl3溶液 | | |
| 3 | 20 | MnO2 | | |
| 4 | 20 | 无 | | |
①实验1、2研究的是________________对H2O2分解速率的影响。
②实验2、3的目的是_______________。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
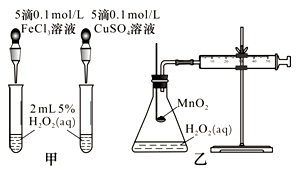
①定性分析:如图甲可通过观察________________,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_______________。
②定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_____________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是 热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是____________________的影响。要证明你的猜想,实验方案是 。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
(1)实验一:取等物质的量浓度等体积H2O2溶液分别进行下列实验,实验报告如下表所示。

试回答:
①实验1、2研究的是__________________________对H2O2分解速率的影响。
②实验2、3的目的是_______________________________________________。
(2)实验二:经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
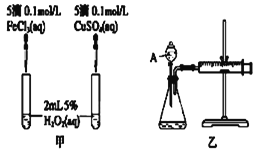
① 定性分析:如图甲可通过观察________________________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_________________________。
②定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。实验中需要测量的数据是__________________________________。
(3)实验三:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显但不久突然褪色,反应速率明显加快。
①针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_____________________的影响。
②若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是_________。
A、硫酸钾 B、硫酸锰 C、水 D、氯化锰
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
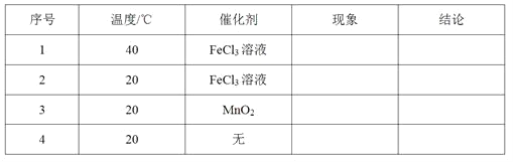
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
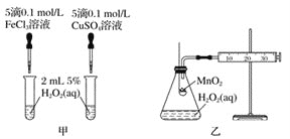
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
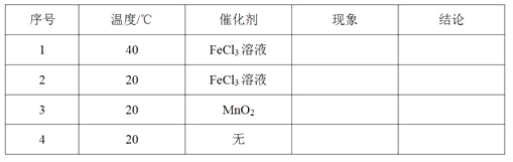
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
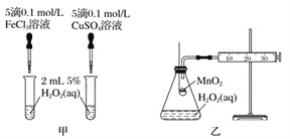
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
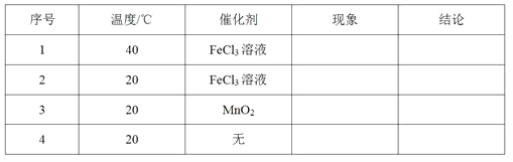
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
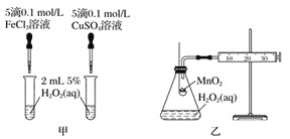
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验方法进行探究。
(1)取等物质的量浓度、等体积的H2O2溶液分别进行H2O2的分解实验,实验报告如下表所示(现象和结论略)。
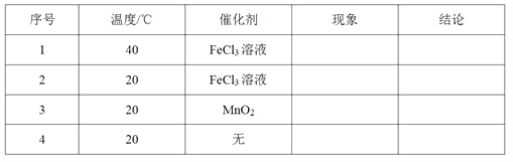
①实验1、2研究的是__________对H2O2分解速率的影响。
②实验2、3的目的是_______________对H2O2分解速率的影响。
(2)查文献可知,Cu2+对H2O2分解也有催化作用,为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
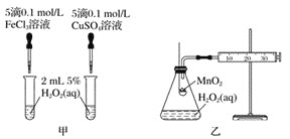
①定性如图甲可通过观察_______,定性比较得出结论。有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是_________。
②定量如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是__________。
(3)酸性高锰酸钾溶液和草酸溶液可发生反应:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,实验时发现开始反应速率较慢,溶液褪色不明显,但一段时间后突然褪色,反应速率明显加快。对此展开讨论:
①某同学认为KMnO4与H2C2O4的反应是______热反应,导致_______________;
②从影响化学反应速率的因素看,你认为还可能是________的影响。要证明你的猜想,实验方案是________________。














