-
下列生活中常见物质在水中主要以离子形式存在的是
A. 食醋 B. 苏打 C. 蔗糖 D. 酒精
难度: 简单查看答案及解析
-
下列关于元素第一电离能的说法不正确的是( )
A. 钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B. 因同周期元素的原子半径从左到右逐渐减小,故第一电离能必定依次增大
C. 最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D. 对于同一元素而言,原子的逐级电离能越来越大
难度: 中等查看答案及解析
-
酸碱中和滴定实验中,不需要用到的仪器是
A.
B.
 C.
C.  D.
D. 难度: 简单查看答案及解析
-
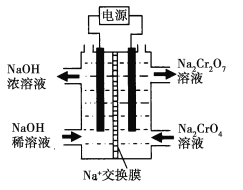
下列解释相关的离子方程式错误的是( )
A. H2S溶于水:H2S+H2O
HS-+H3O+
B. 向Na2S2O3溶液中加入稀硫酸:S2O3-+2H+=S↓+SO2↑+H2O
C. NH4Cl溶液呈酸性:NH4++H2O=NH3·H2O+H+
D. K2Cr2O7溶于水:Cr2O7-+H2O
2CrO42-+2H+
难度: 简单查看答案及解析
-
在一密闭容器中,当反应aA(g)
bB(g)+cC(g)达到平衡后,保持温度不变,将容器体积增加一倍,最终测得A的物质的量的浓度为原来的55%,则
A. 平衡向正反应方向移动 B. a>b+c
C. 物质B的质量分数增大 D. 以上判断都错误
难度: 中等查看答案及解析
-
环保、安全的铝—空气电池的工作原理如下图所示,下列有关叙述错误的是
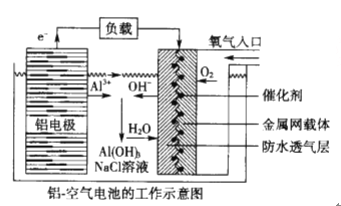
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为: O2 +4e- + 2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1molKIO3,消耗铝电极的质量为54g
难度: 中等查看答案及解析
-
已知可逆反应X(g)+2Y(g)
Z(g) ΔH <0,一定温度下,在体积为2 L的密闭容器中加入4 mol Y和一定量的X后,X的浓度随时间的变化情况如图所示,则下列说法正确的是( )

A. 若向该容器中加入1molX、2molY,达平衡时,X的平衡浓度小于0.125mol/L
B. a点正反应速率大于逆反应速率
C. 反应达平衡时,降低温度可以实现c到d的转化
D. 该条件下,反应达平衡时,平衡常数K=3
难度: 中等查看答案及解析