-
Ⅰ.某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验
编号
0.01 mol·L-1酸性KMnO4溶液
0.1 mol·L-1
H2C2O4溶液
水
反应温度/℃
反应时间/s
①
5.0mL
5.0mL
0
20
125
②
V1
V2
2.0mL
20
320
③
5.0mL
5.0mL
0
50
30
反应方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 = K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O
(1)实验的记时方法是从溶液混合开始记时,至_________________时,记时结束。
(2)实验①和②研究浓度对反应速率的影响,则V1=______mL , V2=_______mL。
(3)下列有关该实验的叙述正确的是_________。
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0 mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数。
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是__________;
Ⅱ. 某草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25. 00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。
(1)若滴定终点时仰视读数,则所测x的值将 _____(填“偏大”或“偏小”)。
(2)x=_________。
高二化学实验题困难题查看答案及解析
-
Ⅰ某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验
编号
0.01 mol·L-1酸性KMnO4溶液
0.1 mol·L-1
H2C2O4溶液
水
反应温度/℃
反应时间/s
①
5.0mL
5.0mL
0
20
125
②
V1
V2
2.0mL
20
320
③
5.0mL
5.0mL
0
50
30
反应方程式为:2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑+ 8H2O
(1)实验的记时方法是从溶液混合开始记时,至 时,记时结束。
(2)实验①和②研究浓度对反应速率的影响,则V1= mL , V2= mL。
(3)下列有关该实验的叙述正确的是 。
A.实验时必须用移液管或滴定管来量取液体的体积
B.实验时应将5.0 mLKMnO4溶液与5.0mL H2C2O4溶液混合后,立即按下秒表,再将盛有混合液的烧杯置于相应温度的水浴中至反应结束时,按下秒表,记录读数。
C.在同一温度下,最好采用平行多次实验,以确保实验数据的可靠性
D.实验①和③可研究温度对反应速率的影响
(4)某小组在进行每组实验时,均发现该反应是开始很慢,突然会加快,其可能的原因是 ;
Ⅱ某草酸晶体的化学式可表示为H2C2O4 • xH2O,为测定x的值,进行下列实验:
①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25. 00mL所配溶液置于锥形瓶中,加入适量稀H2SO4,用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL。
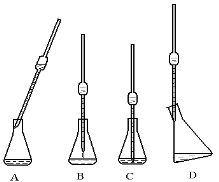
(1)移取所配溶液25.00 mL于锥形瓶中,操作如图所示(手持部分省略):正确的操作是图 。
(2)x= 。
高二化学实验题困难题查看答案及解析
-
(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验编号
0.01mol·L-1
酸性KMnO4溶液
0.1mol·L-1
H2C2O4溶液
水
1mol·L-1
MnSO4溶液
反应温度
/℃
反应时间
I
2mL
2mL
0
0
20
125
II
____mL
____mL
1mL
0
20
320
III
____mL
__ _mL
___mL
0
50
30
IV
2mL
2mL
0
2滴
20
10
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O
高二化学填空题中等难度题查看答案及解析
-
某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验
编号
0.01mol•L﹣1
酸性KMnO4溶液
0.1mol•L﹣1
H2C2O4溶液
水
1mol•L﹣1
MnSO4溶液
反应温度
/℃
反应时间
Ⅰ
2mL
2mL
0
0
20
125
Ⅱ
V1 mL
V2 mL
1mL
0
20
320
Ⅲ
V3 mL
V4 mL
V5 mL
0
50
30
Ⅳ
2mL
2mL
0
2滴
20
10
已知:反应的方程式(未配平):KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O
(1)实验记时方法是从溶液混合开始记时,至 时记时结束;
(2)实验I和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.则V1= V2= V3= V4= V5= ;
(3)从实验数据分析,实验I和IV研究 对反应的影响;
(4)请配平上面的化学方程式: KMnO4+ H2C2O4+ H2SO4= K2SO4+ MnSO4+ CO2↑+ H2O
高二化学实验题困难题查看答案及解析
-
(10分)某研究性学习小组为了研究影响化学反应速率的因素,设计如下方案:
实验编号
0.01mol·L-1
酸性KMnO4溶液
0.1mol·L-1
H2C2O4溶液
水
1mol·L-1
MnSO4溶液
反应温度
/℃
反应时间
I
2mL
2mL
0
0
20
125
II
____mL
____mL
1mL
0
20
320
III
____mL
__ _mL
___mL
0
50
30
IV
2mL
2mL
0
2滴
20
10
已知:反应的方程式(未配平):KMnO4 + H2C2O4 + H2SO4 —— K2SO4 + MnSO4 + CO2↑+ H2O
(1)实验记时方法是从溶液混合开始记时,至___ ___ __时记时结束。
(2)实验I和II研究浓度对反应速率的影响,实验I和III研究温度对反应速率的影响。请在上表空格中填入合理的实验数据。
(3)从实验数据分析,实验I和IV研究________对反应的影响。
(4)请配平上面的化学方程式:
KMnO4 + H2C2O4 + H2SO4= K2SO4 + MnSO4 + CO2↑+ H2O
高二化学填空题中等难度题查看答案及解析
-
某化学实验小组用酸性KMnO4溶液与草酸(H2C2O4)溶液反应,研究外界条件对反应速率的影响,实验操作及现象如下:
编号
实验操作
实验现象
I
向一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入1滴3 mol/L硫酸和9滴蒸馏水,最后加入1 mL 0.1 mol/L草酸溶液
前10 min内溶液紫色无明显变化,后颜色逐渐变浅,30 min后几乎变为无色
II
向另一支试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,再加入10滴3 mol/L硫酸,最后加入1 mL 0.1 mol/L草酸溶液
80 s内溶液紫色无明显变化,后颜色迅速变浅,约150 s后几乎变为无色
(1)写出高锰酸钾与草酸反应的离子方程式:______________________________。
(2)由实验I、II可得出的结论是_______________________________。
(3)关于实验II中80 s后溶液颜色迅速变浅的原因,该小组提出猜想:反应中生成的Mn2+对该反应有催化作用。利用提供的试剂设计实验III,验证猜想。提供的试剂:0.01 mol/L酸性 KMnO4溶液,0.1 mol/L草酸溶液,3 mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水补全实验III的操作:向试管中先加入1 mL 0.01 mol/L酸性KMnO4溶液,_______,最后加入1 mL 0.1 mol/L草酸溶液。

(4)该小组拟采用如图所示的实验方案继续探究KMnO4溶液浓度对反应速率的影响。你认为他们的实验方案______(填“合理”或“不合理”),理由是___________。
高二化学实验题简单题查看答案及解析
-
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
实验序号
A溶液
B溶液
①
20 mL 0.1 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
②
20 mL 0.2 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
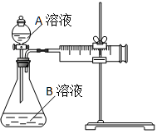
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
高二化学填空题困难题查看答案及解析
-
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
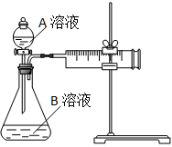
实验序号
A溶液
B溶液
①
20 mL 0.1 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
②
20 mL 0.2 mol·L-1H2C2O4溶液
30 mL 0.01 mol·L-1KMnO4溶液
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
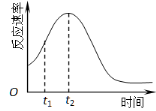 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:① ;② 。
高二化学填空题简单题查看答案及解析
-
(11分)某探究小组用KMnO4酸性溶液与H2C2O4溶液反应过程中溶液紫色消失的方法,研究影响反应速率的因素。
(1)实验条件作如下限定:所用KMnO4酸性溶液的浓度可选择0.01 mol·L-1、0.001 mol·L-1, 催化剂的用量可选择0.5g、0g,实验温度可选择298K、323K。每次实验KMnO4酸性溶液的用量均为4 mL、H2C2O4溶液(0.1 mol·L-1)的用量均为2mL。如果要探究反应物浓度、温度、催化剂对反应速率的影响,通过变换这些实验条件,至少需要完成_______个实验进行对比即可得出结论。
(2)在其它条件相同的情况下,某同学改变KMnO4酸性溶液的浓度,测得以下实验数据(从混合振荡均匀开始计时):
KMnO4酸性溶液
的浓度 / mol·L-1
溶液褪色所需时间 t / min
第1次
第2次
第3次
0.01
14
13
11
0.001
6
7
7
① 计算用0.001 mol·L-1 KMnO4酸性溶液进行实验时KMnO4的平均反应速率(忽略混合前后溶液的体积变化)。
② 若不经过计算,直接看表中的褪色时间长短来判断浓度大小与反应速率的关系是否可行?____________。若不可行(若认为可行则不填),请设计可以通过直接观察褪色时间长短来判断的改进方案:________
高二化学填空题简单题查看答案及解析
-
某实验小组利用KMnO4酸性溶液与H2C2O4溶液反应研究影响反应速率的因素。设计实验方案如下(实验中所用KMnO4溶液均已加入H2SO4):
(1)通过测定单位时间内生成CO2气体体积的大小来比较化学反应速率的大小。实验装置如图,实验时分液漏斗中A溶液一次性放下,A、B的成分见下表:
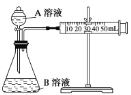
序号
A溶液
B溶液
①
2mL0.1mol/LH2C2O4溶液
4mL0.01mol/LKMnO4溶液
②
2mL0.2mol/LH2C2O4溶液
4mL0.01mol/LKMnO4溶液
③
2mL0.2mol/LH2C2O4溶液
4mL0.01mol/LKMnO4溶液和少量MnSO4
该实验探究的是___对化学反应速率的影响。在反应停止之前,相同时间内针管中所得CO2的体积由大到小的顺序是___(用实验序号填空)。
(2)某组同学利用如图完成该实验。请分析导管a的两点作用:①___;②___。
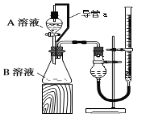
高二化学实验题中等难度题查看答案及解析