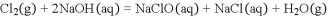-
《本草纲目》记载酿酒之法,“用浓酒和糟入甑,蒸令气上,用器承取滴露”。文中涉及的操作方法是
A. 蒸馏 B. 过滤 C. 溶解 D. 结晶
难度: 简单查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子最外层电子数是内层的2倍,Y是地壳中含量最高的元素,Y与Z形成的化合物能与NaOH溶液反应,其生成物是常用防火材料。X、Y、Z、W最外层电子数之和为19。下列说法错误的是
A. 常温常压下X的单质为固态
B. 原子半径:r(Z)>r(W)>r(Y)
C. Y的简单气态氢化物的热稳定性比Z的氢化物强
D. W的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析
-
化学与生产、生活、技术密切相关,下列说法错误的是( )
A.
可制作胃酸中和剂 B.
可广泛用于食品增白
C. 食盐中加入
可以防治碘缺乏症 D.
用于测定文物的年代
难度: 中等查看答案及解析
-
下列有关物质性质和用途正确且有对应关系的是( )
物质
性质
用途
A
铝
易被氧化,表面形成致密的氧化物薄膜
铝制餐具可以蒸煮酸性或碱性食物
B
小苏打
能与酸反应产生气体
作发酵剂
C
硫酸钡
难溶于水
用作“钡餐”
D
强氧化性
用于环境消毒
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列仪器的使用或操作(夹持装置略去)正确的是( )
A.
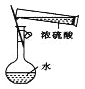 配制一定物质的量浓度的稀硫酸
配制一定物质的量浓度的稀硫酸B.
 制取少量的
制取少量的胶体
C.
 放出用
放出用萃取溴水后的有机层
D.
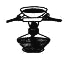 灼烧
灼烧固体
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法正确的是
A. H2O2分解产生1 mol O2转移电子数为4NA
B. 0.1mol H2和0.1mol碘蒸气在密闭容器中充分反应,容器内分子总数为0.2NA
C. 1mol NaHSO4熔融时电离出的阳离子数目为2NA
D. S8分子结构如图,1mol该分子中含有S—S键个数为7NA
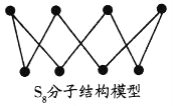
难度: 中等查看答案及解析
-
下列离子方程式的书写正确的是( )
A.
溶于
溶液:
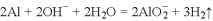
B. 漂白粉溶液中通入少量
:
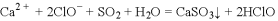
C. 食醋除去瓶胆内的水垢:
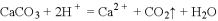
D. 用惰性电极电解硫酸铜溶液:
难度: 中等查看答案及解析
-
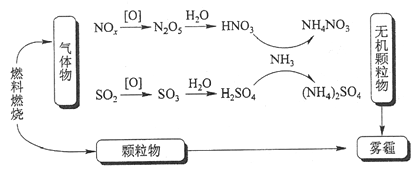
一种新型微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。下列说法正确的是
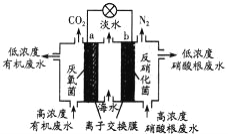
A. a为电池的正极
B. 海水淡化的原理是:电池工作时,Na+移向左室,C1-移向右室
C. 处理NO的电极反应为:2 NO+6H2O+10e-===N2↑+12OH-
D. 若用C6H12O6表示有机废水中有机物,每消耗1 mol C6H12O6转移6 mol e-
难度: 中等查看答案及解析
-
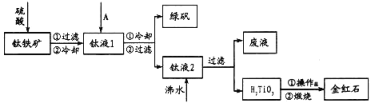
以高硫铝土矿(主要成分为
、
、
,少量
)为原料,生产
的部分工艺流程如下:
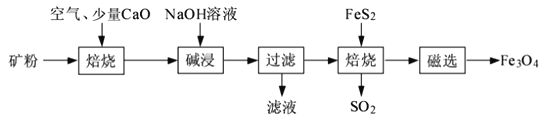
下列说法错误的是( )
A. 用
溶液吸收焙烧过程产生的
有利于保护环境和资源再利用
B. 从高硫铝土矿中可制得
、
的化合物
C. 向“过滤”得到的滤液中通入过量
,铝元素存在的形式由
转化为
D.
与
混合后在无氧条件下焙烧的目的是生成
和
难度: 中等查看答案及解析
-
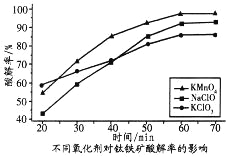
由下列实验及现象能推出相应结论的是( )
实验
现象
结论
A
将
样品溶于稀硫酸后,滴加
溶液
溶液变为血红色
样品已被氧化变质
B
向
溶液中通入
生成白色沉淀
非金属性
C
向盛有
固体的烧瓶中滴加盐酸,并将产生的气体通入溴水中
溴水褪色
还原性:
D
向无色溶液中滴入
溶液和稀硝酸
有白色沉淀生成
无色溶液中一定含
或
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
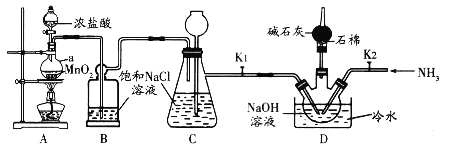
是一种常见的绿色氧化剂,可由臭氧发生器(原理如图)电解稀硫酸制得。下列说法错误的是
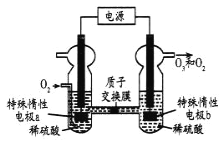
A. 电极a为阴极
B. 标准状况下,当
反应时收集到
和
混合气体
,
的体积分数为80%
C. 电解一段时间后b极周围的
下降
D. a极的电极反应为
难度: 中等查看答案及解析
-
在容积为
的密闭容器内,物质
在
℃时发生反应,其反应物和生成物的物质的量随时间
的变化关系如图,下列叙述不正确的是( )
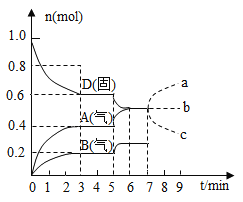
A. 若在第7分钟时增加
的物质的量,则表示
的物质的量变化正确的是a曲线
B. 该反应的化学方程式为
,该反应的平衡常数表达式为
C. 已知反应的
,则第5分钟时图象呈现上述变化的原因可能是升高体系的温度
D. 从反应开始到第一次达到平衡时,
物质的平均反应速率为
难度: 中等查看答案及解析
-
在体积都为
,
都等于2的盐酸和醋酸溶液中,投入
锌粒,则下图所示比较符合客观事实的是( )
A.
B.
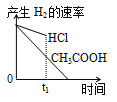 C.
C. D.
难度: 中等查看答案及解析
-
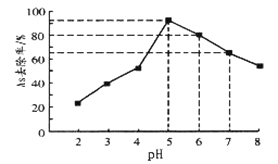
一定温度下,在体积为
的密闭容器中,存在关系
,反应物和生成物的物质的量随时间变化的关系如图所示。下列说法正确的是( )
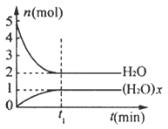
A.
B. 该温度下,反应的平衡常数为
C. 平衡时混合气体的平均摩尔质量是
D.
时刻,保持温度不变,再充入
,重新达到平衡时,
增大
难度: 简单查看答案及解析
-
关于下列各图像的说法中正确的是
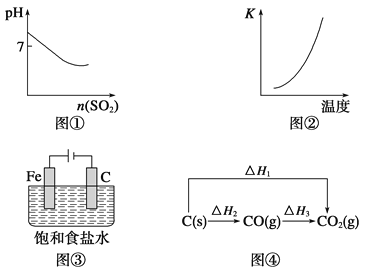
A.图①表示将SO2气体通入溴水中
B.图②表示反应N2(g)+3H2(g)
2NH3(g) ΔH<0的平衡常数K随温度的变化
C.图③中阴、阳两极收集到的气体体积之比一定为1∶1
D.图④中的ΔH1<ΔH2
难度: 中等查看答案及解析