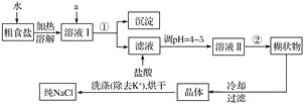
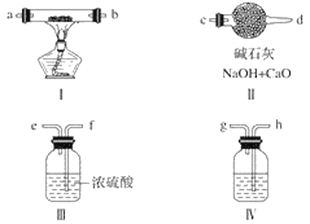
-
向某晶体的溶液中加入Fe2+的溶液无明显变化,当滴加几滴溴水后,混合液出现红色,由此得出下列的结论错误的是
A. Fe3+的氧化性比溴的氧化性强
B. 该晶体中一定含有SCN-
C. Fe2+与SCN-不能形成红色化合物
D. Fe2+被溴水氧化成Fe3+
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 某无色溶液中可能含有下列离子:H+、Cl-、Na+、Fe2+
B. 能使石蕊变红的溶液中可能含有Cl-、K+、Na+、NO3-
C. 取少量某溶液,向其中加入盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成,可证明该溶液中是否含有SO42-
D. H++OH-===H2O可描述所有酸碱中和反应的实质
难度: 中等查看答案及解析
-
为检验一种氮肥的成分,某学习小组的同学进行了以下实验:①加热氮肥样品生成两种气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。②取少量该氮肥样品溶于水,并加入少量BaCl2溶液,没有明显变化。由此可知该氮肥的主要成分是
A. NH4HCO3 B. NH4Cl C. (NH4)2CO3 D. NH4NO3
难度: 中等查看答案及解析
-
向碘水中加入适量CCl4并振荡,静置后观察到的现象是
A. 形成均匀的无色溶液
B. 形成均匀的紫红色溶液
C. 液体分层,下层呈紫红色
D. 液体分层,上下层均呈无色
难度: 中等查看答案及解析
-
歌手那英在歌曲中唱的“雾里看花,水中望月”,其中“雾”属于下列分散系中的
A. 溶液 B. 悬浊液 C. 乳浊液 D. 胶体
难度: 简单查看答案及解析
-
有关胶体等分散系的制备、性质的相关说法不正确的是
A. 向沸水中逐滴加入氯化铁饱和溶液,继续煮沸至液体呈红褐色,即制得氢氧化铁胶体
B. 向氢氧化铁胶体中加入稀硫酸至过量,现象为先生成红褐色沉淀,之后沉淀溶解
C. 依据丁达尔效应可将分散系分为溶液、胶体与浊液
D. 将氢氧化铁胶体与硅酸溶胶相互混合,混合液变浑浊
难度: 简单查看答案及解析
-
对于下列事实的解释错误的是
A. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B. 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C. 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应
D. 铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
难度: 简单查看答案及解析
-
下列各组物质,按电解质、非电解质、既不是电解质也不是非电解质顺序排列的是
A. 硝酸钾、硫酸铜、稀硫酸 B. 空气、水、稀硫酸
C. 氯化钠、乙醇、铜 D. 硝酸、食盐水、烧碱
难度: 简单查看答案及解析
-
下列做法正确的是
A. 用镊子取出白磷并置于水中切割
B. 把氯酸钾制氧气后的残渣倒入垃圾桶
C. 氢气还原氧化铜实验先加热再通氢气
D. 用酒精灯直接给烧杯中的液体加热
难度: 简单查看答案及解析
-
能正确表示下列反应的离子反应方程式为
A. 钠投入足量水中:2Na+2H2O===2Na++2OH﹣+H2↑
B. 氯气溶于水:Cl2+H2O===2H++Cl﹣+ClO﹣
C. 向明矾溶液中滴加过量Ba(OH)2溶液:2Al3++3SO42-+3Ba2++6OH﹣===2Al(OH)3↓+3BaSO4↓
D. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
难度: 简单查看答案及解析
-
在水溶液中能大量共存,且加入过量稀硫酸溶液时,有气体生成的是
A. Na+、Ag+、CO32-、Cl﹣ B. K+、Ba2+、SO42-、Cl﹣
C. Na+、K+、CO32-、Cl﹣ D. Na+、K+、Cl﹣、SO42-
难度: 困难查看答案及解析
-
精确配制250 mL一定物质的量浓度的氢氧化钠溶液,下列实验操作正确的是
A. 选择仪器时,使用500 mL容量瓶
B. 将称量好的氢氧化钠固体放入容量瓶中,加入少量水溶解
C. 在烧杯中溶解氢氧化钠后,立即将所得溶液注入容量瓶中
D. 将烧杯中的氢氧化钠溶液注入未经干燥的洁净容量瓶中
难度: 中等查看答案及解析
-
下列反应中,水作还原剂的是
A.2Na+2H2O=2NaOH+H2↑ B.CaO+H2O=Ca(OH)2
C.3NO2+H2O=2HNO3+NO D.F2+2H2O=4HF+O2
难度: 中等查看答案及解析
-
已知A2On2-可将B2-氧化为B单质,A2On2-则被还原为A3+,又知100 mL的0.3 mol·L-1的A2On2-与150 mL的0.6 mol·L-1B2-恰好完全反应,则A2On2-中的n值为
A. 4 B. 5 C. 6 D. 7
难度: 简单查看答案及解析
-
物质分类的依据通常有组成和性质。下列物质分类中,只考虑组成的是
A. 硫酸钠是钠盐、硫酸盐、正盐
B. 硝酸是一元酸、强酸、挥发性酸
C. 氢氧化镁是二元碱、难溶性碱、中强碱
D. 三氧化硫是酸性氧化物、非金属氧化物、最高价氧化物
难度: 简单查看答案及解析
-
下列反应不属于氧化还原反应的是
A. Zn+2HCl===ZnCl2+H2↑
B. Ca(ClO)2+2HCl===CaCl2+2HClO
C. Pb3O4+8HCl(浓)===3PbCl2+Cl2↑+4H2O
D. 3Cl2+6KOH(浓)
5KCl+KClO3+3H2O
难度: 简单查看答案及解析
-
下列反应中不是氧化还原反应的是
A. 3Cl2+6KOH===5KCl+KClO3+3H2O
B. CuO+H2
Cu+H2O
C. 2KMnO4
K2MnO4+MnO2+O2↑
D. 2AgNO3+BaCl2===2AgCl↓+Ba(NO3)2
难度: 简单查看答案及解析
-
有关接触法制硫酸的叙述,其中不正确的是
A. 用硫磺或含硫矿石均可作为原料
B. 尾气含有二氧化硫,在排入大气前需进行净化处理
C. 接触法制硫酸分为三个流程:硫磺或硫铁矿→SO2;SO2→SO3;SO3→H2SO4
D. 接触法制硫酸的三个阶段都在接触室进行
难度: 简单查看答案及解析
-
下列有关硅和硅的化合物的用途错误的是
A. 硅单质作耐火材料 B. 晶体硅作半导体材料
C. 二氧化硅作光导纤维材料 D. 高纯硅作计算机芯片材料
难度: 简单查看答案及解析
-
将适量金属钠投入下列溶液中,有气体放出,但无沉淀生成的是
A. 盐酸 B. 饱和氢氧化钠溶液
C. FeCl3溶液 D. CuSO4溶液
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A. 向氢氧化钠溶液中通入少量的二氧化硫:SO2+OH-=HSO3-
B. 向新制氯水中通入少量的二氧化硫:Cl2+SO2+2H2O=4H++2Cl-+SO42-
C. 将二氧化硫通入饱和碳酸氢钠溶液:2H++CO32-=H2O+CO2↑
D. 将二氧化硫通入氯化钡溶液:SO2+H2O+Ba2+=BaSO3↓+2H+
难度: 简单查看答案及解析
-
下列物质中不含有硅酸盐的是
A. 玻璃 B. 黏土 C. 硅芯片 D. 普通水泥
难度: 简单查看答案及解析
-
储存浓硫酸的铁罐外口出现严重的腐蚀现象,这体现了浓硫酸的
A. 脱水性和吸水性 B. 吸水性和酸性
C. 强氧化性和吸水性 D. 不挥发性和酸性
难度: 简单查看答案及解析
-
根据氯原子最外层有7个电子,不能推测解释的性质是
A. 氯气在反应中易得到电子 B. 氯气具有强氧化性
C. 氯气具有毒性 D. 氯气是活泼的非金属单质
难度: 简单查看答案及解析
-
已知2Fe2++Br2=2Fe3++2Br-。向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,充分反应后测得溶液中Cl-与Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为
A. 2 mol/L B. 1 mol/L C. 0.4 mol/L D. 0.2 mol/L
难度: 中等查看答案及解析
-
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中通过以下反应制得:3SiO2+6C+2N2
Si3N4+6CO,下列说法正确的是
A. 在氮化硅的合成反应中,氮气是还原剂,二氧化硅是氧化剂
B. 上述反应中每生成1 mol氮化硅,氮气得到12 mol电子
C. 该反应属于四个基本反应类型之一
D. 该反应无有毒气体产生,不需要尾气处理装置
难度: 简单查看答案及解析
-
在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
A. 硅酸钠溶液 B. 氯化钡溶液
C. 石灰水 D. 漂白粉溶液
难度: 中等查看答案及解析
-
(CN)2、(SCN)2的化学性质与卤素单质很相似,化学上称之为拟卤素。它们阴离子的还原性强弱为Cl-<Br-<CN-<SCN-<I-。下列有关反应的叙述中不正确的是
A. Cl2通入NaCN溶液中有(CN)2生成
B. (CN)2在碱液中能生成CN-和CNO-
C. NaBr和KSCN的混合液中加入足量的(CN)2,有Br2和(SCN)2生成
D. 在化学反应中,(CN)2、(SCN)2可作氧化剂
难度: 简单查看答案及解析