-
下列有关“化学与生产、生活和文化”的叙述正确的是
A. 可溶性的铝盐或铁盐可用作处理水的杀菌消毒剂
B. 化石燃料的脱硫脱氮、SO2的回收利用和NOx的催化转化都是减少酸雨产生的措施
C. 食品保存过程中,选用硅胶做抗氧化剂,其使用目的与反应速率有关
D. “取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如乳,尖长者为胜,平短者次之。”文中涉及的操作方法是蒸馏
难度: 中等查看答案及解析
-
根据下列实验中的操作,对应的现象以及结论都正确的是
选项
操作
现象
结论
A
向NaAlO2溶液中滴加NaHCO3溶液
产生白色沉淀
AlO2-结合H+的能力比CO32-强
B
蘸有浓氨水的玻璃捧靠近X
有白烟产生
X —定是浓盐酸
C
将气体分别通入溴水和酸性高锰酸钾溶液中
两溶液均褪色
该气体一定是乙烯
D
炭粉中加入浓硫酸并加热,导出的气体通入BaCl2溶液中
有白色沉淀产生
有SO2和CO2产生
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知阿伏加德罗常数的值为NA。下列说法正确的是( )
A. 标准状况下,2.24LCCl4含有的共价键数为0.4NA
B. 常温下,14 g的
含中子数目为6NA
C. 用铂电极电解100 mL 1 mol • L-1的CuSO4溶液足够长时间,转移电子数一定为0.2NA
D. 将含3NA个离子的Na2O2固体溶于水配成1L溶液,所得溶液中Na+的浓度为2mol/L
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A. Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B. 向含有0.4molFeBr2的溶液中通入0.3molCl2充分反应:4Fe2++2Br-+3Cl2=4Fe3++6Cl-+Br2
C. 向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2A13++3SO42-+3Ba2++6OH-=3BaSO4↓+2A1(OH)3↓
D. 用铁棒作阳极、碳棒作阴极电解饱和氯化钠溶液:2Cl-+2H2O==H2↑+Cl2↑+2OH-
难度: 困难查看答案及解析
-
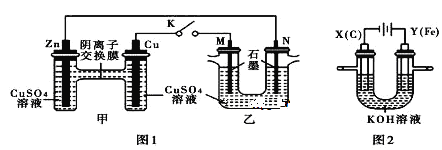
以铅蓄电池为电源,石墨为电极电解CuSO4溶液,装置如下图。若一段时间后Y电极上有6.4 g红色物质析出,停止电解。下列说法正确的是
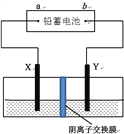
A. a为铅蓄电池的负极
B. 电解过程中,铅蓄电池的负极增重30.3g
C. 电解结束时,左侧溶液质量增重8g
D. 铅蓄电池工作时正极电极反应式为:PbSO4+2e-=Pb+SO42-
难度: 困难查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是
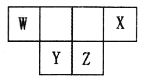
A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
难度: 中等查看答案及解析
-
根据下表提供的数据,判断下列离子方程式或化学方程式正确的是
化学式
电离常数
HClO
K=3×10-8
H2CO3
K1=4×10-7 K2=6×10-11
A. 向Na2CO3溶液中滴加少量氯水:
+2Cl2+H2O===2Cl-+2HClO+CO2↑
B. 向NaHCO3溶液中滴加少量氯水:2
+Cl2===Cl-+ClO-+2CO2↑+H2O
C. 向NaClO溶液中通少量CO2:CO2+NaClO+H2O===NaHCO3+HClO
D. 向NaClO溶液中通过量CO2:CO2+2NaClO+H2O===Na2CO3+2HClO
难度: 中等查看答案及解析