-
一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。
在一恒容密闭容器中分别投入1 mol CO2、3 mol H2,发生反应:2CO2(g) + 6H2(g) C2H4(g) + 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图。则△H______ 0 (填“>” “<” 或“不能确定” )。
C2H4(g) + 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图。则△H______ 0 (填“>” “<” 或“不能确定” )。

Ⅱ. 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ |
| 500 | 800 |
| ①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
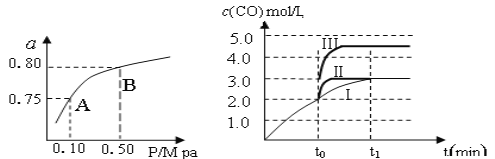
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
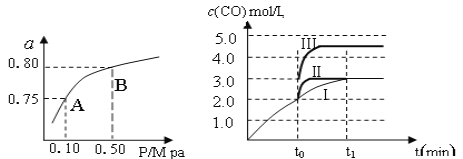
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。
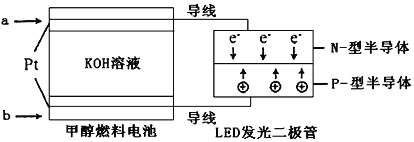
请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________mol/L。
-
一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。
在一恒容密闭容器中分别投入1 mol CO2、3 mol H2,发生反应:2CO2(g)+ 6H2(g) C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图。则△H______ 0 (填“>” “<” 或“不能确定” )。
C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图。则△H______ 0 (填“>” “<” 或“不能确定” )。
Ⅱ. 甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡常数 | 温度℃ |
| 500 | 800 |
| ①2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
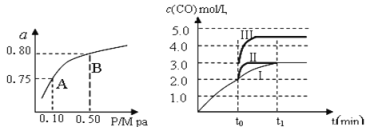
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)甲醇是重要的化工原料,又可作为燃料。对于上述反应①而言:
(I)若该反应在恒温恒容条件下进行,下列说法正确的是_________;
a.若混合气体的平均摩尔质量不再改变,说明反应已达化学平衡状态
b.反应达到平衡后,通入氩气使压强增大,平衡向右移动,CO转化率增大
c.反应达到平衡后,升高温度,平衡逆向移动,平衡常数减小
d.若使用催化剂,会改变反应的途径,反应的焓变减小
(II)某温度下,在一个容积为2L的密闭容器中进行该反应,已知此温度下的平衡常数 K=50,反应到某时刻测得各组分的物质的量如下:
| 物质 | CO | H2 | CH3OH |
| 物质的量/mol | 0.4 | 0.4 | 0.8 |
请比较此时正、逆反应速率的大小:v正 ____v逆(填“>”、“<”或“=”)
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/L Ba(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________mol/L。
-
一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1mol CO2、3 mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。

(1)△H____________ (填“>” “<” 或“不能确定” )0。
(2)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 | 平衡 常数 | 温度℃ |
| 500 | 800 |
| ①2H2(g)+CO(g)  CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)  H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
(1)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如左下图所示。则平衡状态由A变到B时,平衡常数K(A)_____________K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3=_______(用K1、K2表示)。
(2)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如右上图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是_____________________。
(3)一种甲醇燃料电池,使用的电解质溶液是2mol·L-1的KOH溶液。

请写出加入(通入)b物质一极的电极反应式_________________;每消耗6.4g甲醇转移的电子数为_______________。
(4)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合后,溶液中:2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数Ka为________________。
-
一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1mol CO2、3mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。
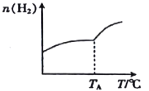
(1)其他条件不变,起始时若按1mol CO2、2mol H2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>” “<” 或“不能确定” )0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
| 化学反应 | 
| 500 | 700 | 800 |
| ①2H2(g)+CO(g) CH3OH(g) △H1 CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g) H2O(g)+CO(g) △H2 H2O(g)+CO(g) △H2 | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2 (g) CH3OH(g)+H2O(g) △H3 CH3OH(g)+H2O(g) △H3 | K3 | | | |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8mol·L-1、0.1mol×L-1、0.3mol·L-1、0.15mol·L-1,则此时v(正)____________(填“>”“ =”或“<””)v(逆)。
(6)下列措施能使反应③的平衡体系中 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1mol H2
Ⅲ.(7)有人设想将CO 按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
-
一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1mol CO2、3 mol H2,发生反应:2CO2(g)+6H2(g) C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图所示。
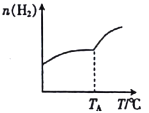
(1)其他条件不变,起始时若按1molCO2、2 molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>” “<” 或“不能确定” )0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
| 化学反应 | 
| 500 | 700 | 800 |
| ①2H2(g)+CO(g) CH3OH(g) △H1 CH3OH(g) △H1 | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g) H2O(g)+CO(g) △H2 H2O(g)+CO(g) △H2 | K2 | 1.0 | 1. 70 | 2.52 |
| ③3H2(g)+CO2 (g) CH3OH(g)+H2O(g) △H3 CH3OH(g)+H2O(g) △H3 | K3 | | | |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500 ℃时测得反应③在某时刻H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为0.8 mol·L-1、0.1mol×L-1、0.3 mol·L-1、0.15 mol·L-1,则此时v(正)____________(填“>”“ =”或“<””)v(逆)。
(6)下列措施能使反应③的平衡体系中 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1mol H2
Ⅲ.(7)有人设想将CO 按下列反应除去:2CO(g)=2C(s) +O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
-
科学假说是科学发展的一种重要形式。有科学家提出: 利用空气中的二氧化碳与氢气反应后,使之变为可再生的燃料甲醇的设想。其设想的生产流程如图。下列说法正确的是
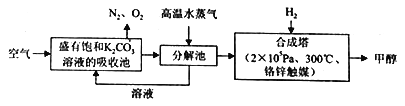
A. 上述流程中饱和碳酸钾溶液所起的作用是降低空气中的CO2 的溶解度
B. 上述流程中能体现“循环利用”的物质有碳酸氢钾溶液和高温水蒸气
C. 从合成塔中分离出甲醇的实验操作方法是分液
D. 通入高温水蒸气的作用是: 加快CO2的生成和逸出,以便及时提供给合成塔
-
绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)  2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g)  NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g)  2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g)  N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示
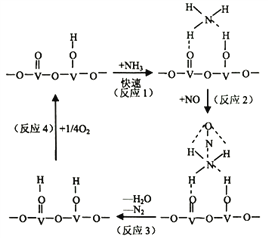
①写出总反应化学方程式__________________________________。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是____________反应(填“吸热”或“放热”)。
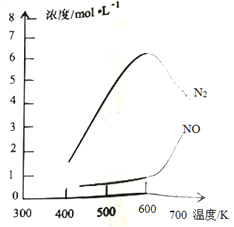
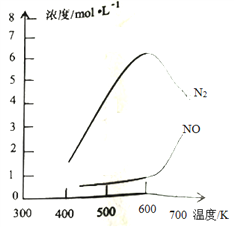
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为____________;当温度达到700K时,发生副反应的化学方程式________________________。
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
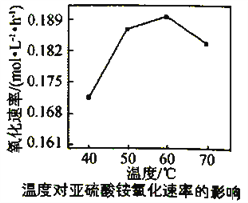
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是________________________;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者____________(填“大”小”)
-
绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)  2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g)  NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g)  2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g)  N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示
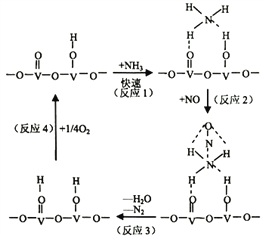
①写出总反应化学方程式__________________________________。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是____________反应(填“吸热”或“放热”)。
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为____________;当温度达到700K时,发生副反应的化学方程式________________________。
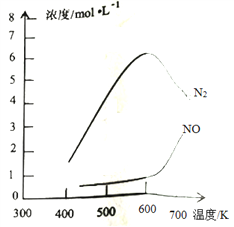
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
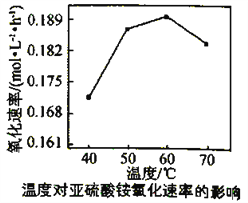
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是________________________;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者____________(填“大”小”)
-
绿水青山是习总书记构建美丽中国的伟大设想,研究碳、氮、硫等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)科学家研究利用某种催化剂,成功实现将空气中的碳氧化合物和氮氧化合物转化为无毒的大气循环物质。已知:
①N2(g)+O2(g)  2NO(g) △H1=+179.5 kJ·mol-1
2NO(g) △H1=+179.5 kJ·mol-1
②NO2(g)+CO(g)  NO(g)+CO2(g) △H2=-234 kJ·mol-1
NO(g)+CO2(g) △H2=-234 kJ·mol-1
③2NO(g)+O2(g)  2NO2(g) △H3=-112.3 kJ·mol-1
2NO2(g) △H3=-112.3 kJ·mol-1
则反应2NO(g)+2CO(g)  N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
N2(g)+2CO2(g)的△H=__________kJ·mol-1;某温度下,反应①②③的平衡常数分别为K1、K2、K3,则该反应的K=__________用K1、K2、K3表示)
(2)用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图所示
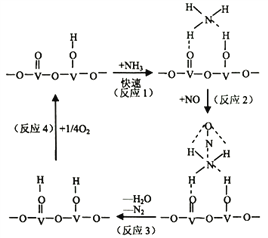
①写出总反应化学方程式__________________________________。
②测得该反应的平衡常数与温度的关系为:1gK=5.08+217.5/T,该反应是____________反应(填“吸热”或“放热”)。
③该反应的含氮气体浓度随温度变化如图所示,则将NO转化为N2的最佳温度为____________;当温度达到700K时,发生副反应的化学方程式________________________。
(3)利用氨水吸收工业废气中的SO2,既可解决环境问题,又可制备(NH4)2SO3。可用(NH4)2SO3为原料,以空气氧化法制备(NH4)2SO4,其氧化速率与温度关系如下图:
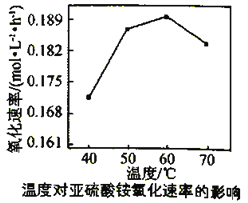
试解释在温度较高时,(NH4)2SO3 氧化速率下降的原因是________________________;相同条件下,等浓度的(NH4)2SO3和(NH4)2SO4溶液中,c(NH4+)前者____________(填“大”小”)
-
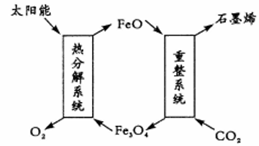
二氯化碳利用具有十分重要的意义,科学家有以下几个设想。
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如下:
①Fe3O4中Fe的化合价是+ 2和 __________;
②重整系统发生反应的化学方程式为______________________________。
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃。在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g) C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。
C2H4 (g)+ 4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右下图所示。

① 其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将_____________(填“增大”、“ 减小”或“不变”);
②△H________0(填“>”“<”“ 不能确定”)。
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4 ________ H2O (填“>”“<”“ 不能确定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq)  NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
NH4+ (aq) +OH-(aq) △H1=a kJ•mol-1
CO2 (g) + H2O(l) H2CO3 (aq) △H2=bkJ•mol-1
H2CO3 (aq) △H2=bkJ•mol-1
H2CO3(aq) + OH-(aq) HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
HCO3-(aq) + H2O(l) △H3=ckJ•mol-1
则利用NH3• H2O吸收CO2制备NH4HCO3的热化学方程式为_____________________________;
②已知常温下相关数据如表:
| Kb(NH3·H2O) | 2×10-5mol • L-1 |
| Ka1(H2CO3) | 4×10-7mol • L-1 |
| Ka2(H2CO3) | 4×10-11mol • L-1 |
则反应NH4++HCO3-+H2O NH3• H2O+ H2CO3的平衡常数k=___________。
NH3• H2O+ H2CO3的平衡常数k=___________。
C2H4(g) +4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2 的物质的量变化关系如图。则△H______ 0 (填“>” “<” 或“不能确定” )。























