-
下列有关化学用语表示正确的是
A.CO2分子比例模型:
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:
D.过氧化氢的电子式:H+
H+
难度: 简单查看答案及解析
-
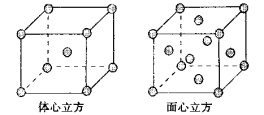
下列有关金属晶体判断正确的是
A.简单立方、配位数6、空间利用率68%
B.钾型、配位数6、空间利用率68%
C.镁型、配位数8、空间利用率74%
D.铜型、配位数12、空间利用率74%
难度: 中等查看答案及解析
-
下列叙述正确的是
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间作用力越大,该分子越稳定
C.金属阳离子只能与阴离子构成晶体
D.正四面体构型的分子中,键角一定为109°28′
难度: 中等查看答案及解析
-
下列一组粒子的中心原子杂化类型相同,分子或离子的键角不相等的是
A.CCl4、SiCl4、SiH4 B.H2S、NF3、CH4
C.BCl3、CH2===CHCl、环已烷 D.SO3、C6H6(苯)、CH3C≡CH
难度: 困难查看答案及解析
-
关于原子结构的叙述中:
①所有原子核均由质子和中子构成;
②原子处于基态时,次外层电子不一定是8个;
③稀有气体元素,其基态原子最外层都是8个电子;
④最外层电子数为2的原子一定是金属原子。
其中正确的是
A.①② B.②③ C.只有② D.只有④
难度: 中等查看答案及解析
-
X、Y是元素周期表ⅦA族中两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
难度: 中等查看答案及解析
-
下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物分子
D.只有非金属原子间才能形成共价键
难度: 中等查看答案及解析
-
在金属晶体中,根据影响金属键的因素判断下列各组金属熔沸点高低顺序,其中正确的是
A.Mg>Al>Ca B.Al>Na>Li
C.Al>Mg>Ca D.Mg>Ba>Al
难度: 中等查看答案及解析
-
现有如下各种说法,正确的是
①在水中氢、氧原子间均以化学键相结合
②金属元素的原子和非金属元素的原子化合均形成离子键
③离子键是阴、阳离子的相互吸引力
④根据电离方程式HCl===H++Cl-,判断HCl分子中存在离子键
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子中共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程
A.①②⑤正确 B.都不正确
C.④正确,其他不正确 D.仅①不正确
难度: 中等查看答案及解析
-
下列轨道表示式能表示氮原子的最低能量状态的是

难度: 简单查看答案及解析
-
下列数据是对应物质的熔点,结合所学知识,有关的判断错误的是
Na2O
Na
AlF3
AlCl3
Al2O3
BCl3
CO2
SiO2
920 ℃
97.8 ℃
1291 ℃
190 ℃
2073 ℃
-107 ℃
-57 ℃
1 723 ℃
A.只要含有金属阳离子的晶体就一定是离子晶体
B.在共价化合物分子中各原子都形成8电子稳定结构
C.同族元素的氧化物可形成不同类型的晶体
D.金属晶体的熔点不一定比分子晶体的高
难度: 中等查看答案及解析
-
第3周期元素的原子,其最外层p能级上仅有一个未成对电子,它最高价氧化物对应的水化物的酸根离子可能是
A.RO2- B.RO3- C.RO42- D.RO4-
难度: 中等查看答案及解析
-
X、Y、Z均为短周期元素,其简单离子X+、Y3+、Z2-的核外电子层结构相同。下列说法不正确的是
A.原子序数:Y>X>Z B.碱性:XOH>Y(OH)3
C.单质的还原性:X>Y D.离子半径:X+>Y3+>Z2-
难度: 中等查看答案及解析
-
下列说法中正确的是
A.C60气化和I2升华克服的作用力相同
B.甲酸甲酯和乙酸的分子式相同,它们的熔点相近
C.氯化钠和氯化氢溶于水时,破坏的化学键都是离子键
D.用作高温高硬度结构陶瓷材料的Si3N4固体是分子晶体
难度: 中等查看答案及解析
-
有下列两组命题
A组
B组
Ⅰ.H2O分子间存在氢键,H2S则无
①H2O比H2S稳定
Ⅱ.晶格能NaI比NaCl小
②NaCl比NaI熔点高
Ⅲ.晶体类型不同
③N2分子比磷的单质稳定
Ⅳ.元素第一电离能大小与原子外围电子排布有关,不一定像电负性随原子序数递增而增大
④同周期元素第一电离能大的,电负性不一定大
B组中命题正确,且能用A组命题加以正确解释的是
A.Ⅰ① B.Ⅱ② C.Ⅲ③ D.Ⅳ④
难度: 困难查看答案及解析
-
下列说法中正确的是
A.核外电子排布完全相同的两种微粒,其化学性质一定相同
B.ⅠA和ⅦA元素单质从上到下,熔沸点逐渐升高,密度逐渐增大
C.一种离子和一种分子的质子数和电子数不可能同时相等
D.共价化合物溶于水过程中,共价键被破坏
难度: 中等查看答案及解析
-
如表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是。
元素代号
A
B
C
D
E
原子半径/nm
0.160
0.143
0.102
0.071
0.099
主要化合价
+2
+3
+6、-2
-1
-1
A.A、B简单离子半径大小关系为B3+>A2+
B.D、E形成的简单离子的还原性:E->D-
C.气态氢化物的稳定性:HD<H2C
D.最高价氧化物对应的水化物的酸性:H2CO4>HEO4
难度: 中等查看答案及解析
-
X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位置关系如图所示。下列说法正确的是
A.五种元素中,原子半径最大的是W
B.Y的简单阴离子比W的简单阴离子还原性强
C.Y与Z形成的化合物都可以和盐酸反应
D.Z与Q形成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
某氧原子的质量为a g,12C原子的质量为b g,且NA表示阿佛加德罗常数,下列说法中不正确的是
A.氧元素的相对原子质量为12a/b
B.1 mol该原子质量为aNA g
C.x g该氧原子所含的电子数为8x/a
D.y g该氧原子的中子数一定为8y/a
难度: 中等查看答案及解析
-
原子序数依次增大的X、Y、Z、M、W为五种短周期元素。已知Y与Z、M与W分别同周期,X与M同主族;X、Z、M的质子数之和等于Y、W的质子数之和;X与Z、M与Z都可以分别形成A2B、A2B2型的化合物;X与Y形成的气态化合物在标准状况下的密度为0.76 g·L-1;Y、M、W的最高价氧化物的水化物,两两间都能发生反应。下列说法不正确的是
A.M的单质可用于从钛、锆等金属的氯化物中置换出钛、锆等单质
B.由X、Y、Z三种元素形成的某种化合物的水溶液,可能呈碱性或酸性
C.由X、M与Z形成的化合物X2Z2和M2Z2中所含的化学键类型相同
D.含有W阳离子的某种盐,可用作净水剂
难度: 困难查看答案及解析