-
化学与生活、生产、环境密切相关,下列有关说法正确的是
A. 冬天大量使用燃煤,会加剧雾霾天气的形成
B. 在食盐中加入大量KIO3,有利于提高碘盐的品质
C. 食品包装袋中常用保鲜剂的组成为铁粉、炭粉和氯化钠,其中炭粉作还原剂
D. 涤纶、塑料和光导纤维都是有机高分子材料
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
D. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
难度: 中等查看答案及解析
-
a、b、c、d是四种短周期主族元素,其原子序数依次增大。a原子核外最外层电子数是次外层的2倍;c是同周期中原子半径最大的元素;工业上一般通过电解d的熔融氧化物的方法获得d的单质;d原子最外层电子数是b的1/2。下列说法正确的是
A. a与b形成的化合物中含有离子键和共价键
B. 由四种元素中的三种组成的无机盐溶于水均可促进水的电离
C. 简单离子半径:d>b>c
D. 相同质量的c、d的单质分别与足量盐酸反应,前者生成的氢气多
难度: 中等查看答案及解析
-
下列实验方案正确且能达到实验目的的是
A.
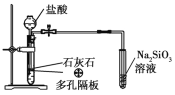 证明碳酸的酸性比硅酸强
证明碳酸的酸性比硅酸强B.
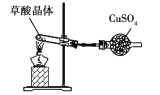 验证草酸晶体是否含结晶水
验证草酸晶体是否含结晶水C.
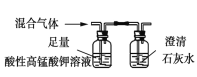 检验混合气体中H2S和CO2
检验混合气体中H2S和CO2D.
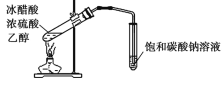 制备乙酸乙酯
制备乙酸乙酯难度: 中等查看答案及解析
-
氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是
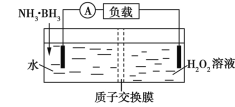
A. 正极的电极反应式为2H++2
═H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
难度: 困难查看答案及解析
-
2,4−二氯苯乙酸是生产新型杀虫、杀螨剂螺螨酯的关键中间体,其结构简式如图所示。下列有关说法错误的是( )
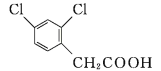
A. 该有机物能发生加成反应、取代反应
B. 该有机物的分子式为C8H6Cl2O2
C. 改变氯原子在苯环上的位置,还可得到8种结构
D. 该有机物分子中所有的碳原子可能同时处于同一平面
难度: 中等查看答案及解析
-
常温下PbSO4、PbCO3的溶度积常数分别为1.7×
、7.4×
,下列说法错误的是
A. PbSO4的饱和溶液中,c(Pb2+)约为1.3×
B. 反应PbSO4(s)+CO32-(aq)
PbCO3(s)+SO42-(aq)的平衡常数约为4.4×
C. 向c(CO32-)=c(SO42-)的混合液中滴加Pb(NO3)2溶液,先得到PbCO3沉淀
D. PbCO3在水中的溶解度比在Pb(NO3)2溶液中的大
难度: 中等查看答案及解析
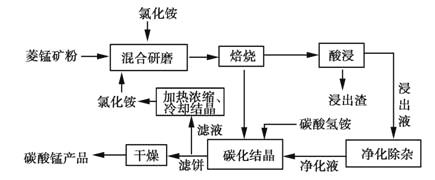
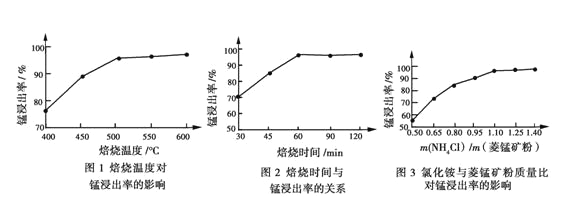
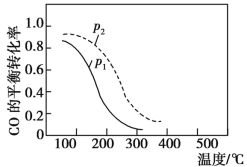
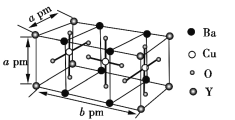
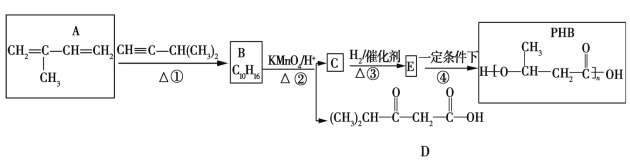
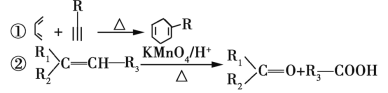
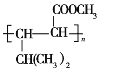 的合成路线(其他试剂任选)______________。
的合成路线(其他试剂任选)______________。